3.1 Épreuves de tuberculination (mis à jour janvier 2017)
1. Cette section porte sur la technique de tuberculination seulement. Des informations au sujet de la maladie, la tuberculose bovine, sont disponibles sur le site web de l'ACIA.
2. La réalisation d'épreuves cutanées à la tuberculine dans les troupeaux d'animaux d'élevage est, depuis de nombreuses années, un élément fondamental de la surveillance active à la ferme dans le cadre du Programme national d'éradication de la tuberculose bovine (PNÉTB). Les épreuves sont également réalisées à des fins d'importation, d'exportation ou d'introduction dans les centres de production de sperme animal, ainsi que pour appuyer les enquêtes sur la maladie. Une épreuve de tuberculination consiste à induire une réaction d'hypersensibilité retardée à l'aide d'une injection intradermique de substances antigéniques dérivées d'une souche de laboratoire de Mycobacterium bovis (M. bovis). La réaction d'hypersensibilité entraîne une accumulation de cellules et de liquides dans le derme, provoquant une tuméfaction au point d'injection. Chez les animaux positifs, la réaction intradermique se produit dans les 24 heures suivant l'injection, et elle devient maximale après 48 à 72 heures, caractérisée par un érythème et de la tuméfaction, mais se manifeste rarement par une induration ou une ulcération.
3. Les épreuves de tuberculination intradermique présentent 2 susmentionné limitations :
- certains animaux infectés par M. bovis ne réagissent pas à l'épreuve (faux négatifs).
Le nombre d'animaux qui entrent dans cette catégorie donne la mesure de la sensibilité de l'épreuve, la sensibilité étant la probabilité que l'épreuve permette de reconnaître comme réagissants les animaux qui sont véritablement infectés. Les faux négatifs résultent de diverses raisons, notamment l'utilisation de tuberculine de mauvaise qualité, une technique de tuberculination inappropriée, la chronicité et la gravité de la maladie, ou des variations concernant le moment de réalisation de l'épreuve liées au vêlage et à des épreuves de tuberculination précédentes. - certains animaux qui ne sont pas infectés par M. bovis réagissent à l'épreuve (faux positifs).
Le nombre d'animaux qui entrent dans cette catégorie donne la mesure de la spécificité de l'épreuve, la spécificité étant la probabilité que l'épreuve permette de reconnaître comme négatifs les animaux qui sont véritablement non infectés. La plupart des animaux ayant obtenu un résultat faux positif ont été exposés à des antigènes qui ressemblent ou qui sont identiques à ceux de la tuberculine.
4. La sensibilité et la spécificité sont des caractéristiques de l'épreuve cutanée à la tuberculine et ne dépendent pas de la population qui est soumise à l'épreuve (c'est-à-dire si la population est indemne de tuberculose (TB) ou effectivement atteinte de TB à une certaine prévalence). Toutefois, la prévalence de la TB dans une population a une influence sur la probabilité qu'un animal réagissant soit vraiment infecté par M. bovis (la valeur prédictive positive d'un résultat positif). Les valeurs prédictives positives et négatives dépendent de la prévalence de la maladie dans la population soumise à l'épreuve. Plus la prévalence est élevée dans une population, plus un animal réagissant à l'épreuve de tuberculination est susceptible d'être effectivement atteint de la maladie, plus que dans le cas où l'épreuve est réalisée sur une population où la prévalence est faible.
Approvisionnement, manipulation, entreposage, utilisation et élimination de la tuberculine
5. Toutes les tuberculines utilisées au Canada sont produites par le Centre des produits biologiques du Laboratoire d'Ottawa à Fallowfield (LOF) de l'Agence canadienne d'inspection des aliments (ACIA). La tuberculine bovine, un dérivé protéinique purifié (PPD) d'une culture de M. bovis, est produite par l'ACIA et contient 3250 UI dans chaque 0,1 ml.
6. Le bureau de district fournit la tuberculine sans frais aux vétérinaires accrédités. Les vétérinaires accrédités qui désirent se procurer de la tuberculine doivent communiquer avec le bureau de district.
7. Compte tenu que la tuberculine peut être obtenue rapidement, il est inutile d'en accumuler des stocks en prévision de besoins futurs. L'accumulation entraîne une augmentation de pertes inutiles de tuberculine et donne lieu à des pénuries.
8. La date de péremption de la tuberculine est de 1 année à compter de la date de l'évaluation de la puissance, lorsqu'elle est manipulée et entreposée de façon adéquate, mais idéalement, il faut l'utiliser en quelques mois après la réception. Il importe de bien gérer les stocks de tuberculine pour qu'ils ne soient pas périmés avant leur utilisation. Une épreuve effectuée avec une tuberculine expirée est invalide.
9. Toujours vérifier la date de péremption de la tuberculine avant de l'utiliser. Ne pas utiliser de tuberculine périmée. Une épreuve de tuberculination n'est valide que si elle est réalisée avant la date de péremption indiquée sur le flacon ou à cette même date. En cas d'utilisation par inadvertance de tuberculine périmée pour effectuer une épreuve officielle de dépistage de la TB, il faudra répéter l'épreuve à la fin de la période d'attente nécessaire, tel qu'il est requis pour l'épreuve de tuberculination en question. Communiquer immédiatement avec le bureau de district pour obtenir de plus amples renseignements.
10. Pour que l'épreuve soit fiable, la tuberculine doit être manipulée et utilisée selon des exigences rigoureuses :
- entreposer la tuberculine dans un endroit frais (4 °C) et la protéger de la lumière.
La tuberculine exposée pendant plus que quelques heures à des températures extrêmes ou à la lumière du soleil est inutilisable. - toujours emballer la tuberculine avec de la glace ou des cryosacs congelés au cours du transport.
- utiliser une technique aseptique adéquate lors de la manipulation de la tuberculine.
Pour éviter la contamination de la tuberculine, désinfecter le bouchon du flacon après avoir retiré le sceau en aluminium. - se départir immédiatement de la tuberculine périmée comme suit :
- jeter en tant que déchet biologique; ou
- retourner au bureau de district de l'ACIA (seulement les flacons pleins et non ouverts)
- prière de retourner aussi au bureau de district la tuberculine qui n'est plus destinée à être utilisée en pratique. (seulement les flacons pleins et non ouverts).
11. Il est à souligner que la tuberculine ne doit être utilisée que par des vétérinaires accrédités formés et qualifiés.
Notes sur l'épreuve de tuberculination
12. La réalisation de l'épreuve peut nécessiter un temps de déplacement considérable et de nombreuses heures pour soumettre tous les animaux à l'épreuve. Pour faciliter ce processus, il est important de se préparer à l'avance afin de s'assurer que tout le matériel sera disponible sur les lieux de réalisation de l'épreuve.
Seringues et aiguilles
13. À l'aide d'une seringue à tuberculine de 1 ml, prélever une seule dose de tuberculine. Il n'est pas permis de charger la seringue avec plusieurs doses.
14. Utiliser une nouvelle aiguille pour chaque animal : calibre 26, ⅜ po de long.
15. Il est à noter que les seringues à tuberculine peuvent être remplies de nouveau, en utilisant une nouvelle aiguille pour chaque animal.
16. Ne pas remplir à l'avance les seringues avec la tuberculine avant la réalisation de l'épreuve, quelles que soient les circonstances.
Épreuves disponibles
17. Les épreuves de tuberculination suivantes ne peuvent être réalisées que par des vétérinaires accrédités formés et qualifiés :
- épreuve de tuberculination au pli caudal (TPC) chez les bovins, bisons, chèvres et moutons.
- épreuve de tuberculination médiocervicale (TMC) chez les cervidés.
- épreuve de tuberculination post-axillaire simple pour les camélidés.
- épreuve de tuberculination à la base de l'oreille pour les porcs.
18. Pour les vétérinaires accrédités, la formation et qualification comportent les éléments suivants :
- réviser cette section du manuel avec un vétérinaire de district; et
- démonstration à la ferme par un vétérinaire de l'ACIA et pratique de la technique chez des animaux vivants.
De la saline stérile peut être utilisée pour pratiquer l'injection. Le vétérinaire de district doit inscrire au dossier du vétérinaire accrédité la date et le lieu de la pratique à la ferme.
19. Pour assurer l'exactitude des résultats des épreuves réalisées dans le cadre du PNÉTB, il est essentiel que la même personne effectue les mesures le jour de l'injection et le jour de la lecture de ces épreuves, sauf en cas de circonstances exceptionnelles où cela s'avère impossible (absence imprévue et inévitable).
20. L'épreuve de tuberculination à la base de l'oreille réalisée sur les porcs n'est pas une épreuve officielle pour le dépistage de la TB bovine dans le cadre du PNÉTB, et elle n'est réalisée que dans le cadre de programmes d'exportation de porcs vivants et de semence de porcine. Étant donné le nombre d'animaux qui sont soumis parfois à cette épreuve, les exigences des protocoles de biosécurité à respecter pour entrer dans un lieu d'élevage de porcs et le fait que les opérations commerciales de porcs au Canada soient exemptes de TB bovine, les inspections le jour de l'injection et le jour de la lecture devraient être effectuées par la même personne si cela est possible et réalisable.
Activités connexes
21. Si le propriétaire ou l'exploitant a l'intention d'administrer des médicaments aux animaux (par exemple, vaccins, médicaments antiparasitaires) pendant qu'ils sont soumis aux épreuves de dépistage de la TB, tous les médicaments doivent être administrés lors de la lecture des épreuves de tuberculination, et non au moment de l'injection de la tuberculine. Cela permet de récupérer les carcasses à des fins d'alimentation humaine dans le cas où les animaux doivent être détruits en raison des résultats des épreuves ou d'une blessure et d'éviter toute interférence entre les médicaments et les résultats des épreuves.
Date de l'épreuve
22. La date de l'épreuve de tuberculination doit être consignée sur le formulaire de rapport d'épreuve intradermique, y compris la date de l'injection de la tuberculine et la date de lecture. Pour des fins d'exportation et l'entrée en centre de production de sperme, la date de test est la date de lecture du test de tuberculination.
23. Afin de calculer l'intervalle de temps qui s'est écoulé depuis la réalisation d'une épreuve de tuberculination, utiliser la date de l'injection de la tuberculine.
Épreuve de tuberculination au pli caudal (TPC)
Préparation
24. L'épreuve de TPC est l'épreuve standard officielle pour le dépistage de la TB chez les bovins, bisons, moutons et chèvres à faible risque pour la tuberculose.
25. L'épreuve consiste en une injection intradermique de 0,1 ml de tuberculine PPD bovine à l'un des plis caudaux avec examen et palpation au bout de 72 heures (± 6 heures) après l'injection.
26. Ne pas réaliser l'épreuve de TPC chez un animal ayant subi une épreuve de tuberculination de quelque nature qu'elle soit au cours des 60 jours précédents.
27. Préparer le matériel suivant :
tuberculine – tuberculine PPD bovine (à entreposer dans un endroit sombre à 4 °C)
seringues – seringues à tuberculine de 1 ml
aiguilles – calibre 26, ⅜ po de long
ouate absorbante
Formulaire CFIA/ACIA 1524 – Rapport d'épreuve intradermique
lampe frontale ou lampe de poche en cas de mauvais éclairage
28. Veiller à ce que la contention de chaque animal soumis à l'épreuve soit adéquate pour qu'il soit possible de bien identifier l'animal, préparer le point d'injection, d'injecter la tuberculine avec précision, et d'interpréter correctement les résultats de l'épreuve. Ne pas réaliser ou observer l'épreuve sans que l'animal ne soit correctement immobilisé.
29. Consigner sur le formulaire CFIA/ACIA 1524 l'identification individuelle de chaque animal soumis à l'épreuve. Les méthodes d'identification acceptables d'un animal sont les suivantes : une étiquette approuvée (ou considérée équivalente) sous le Programme d'identification et traçabilité des animaux d'élevage (TRACE), une étiquette d'oreille HofA (Health of Animals = Santé des animaux) ou un tatouage enregistré.
30. Le point d'injection se trouve sur le pli sous-caudal, en position distale par rapport à la base de la queue, à bonne distance de la limite du pelage, au centre du pli. La tuberculine peut être administrée du côté gauche ou du côté droit, mais adopter la même technique pour tous les animaux. Si une lésion est détectée sur le pli sous-caudal, utiliser le pli opposé et prendre note de ce changement.
Injection
31. Nettoyer le pli sous-caudal à la ouate (humectée à l'eau au besoin). Ne pas utiliser d'alcool pour nettoyer le point d'injection. Consigner sur le formulaire CFIA/ACIA 1524 toutes les anomalies, lésions ou croûtes visibles autour du point d'injection pour éviter qu'elles ne soient prises par erreur pour des signes de réaction à la tuberculine.
32. Vérifier l'étiquette de la tuberculine pour confirmer le type – la tuberculine dérivée de M. bovis porte une étiquette orange.
33. Vérifier ou confirmer la date de péremption de la tuberculine par rapport à la date actuelle.
34. Désinfecter le bouchon en caoutchouc avec de l'alcool après avoir retiré le sceau en aluminium.
35. Remplir la seringue avec 0,1 ml de tuberculine. Une seule dose doit être prélevée.
36. D'une main, relever la queue, puis localiser les plis sous-caudaux.
37. Insérer l'aiguille dans le derme de la peau, sur la ligne centrale du pli sous-caudal droit ou gauche, en position distale par rapport à la base de la queue et à distance de la limite du pelage. Être uniforme et effectuer l'injection du même côté chez tous les animaux de l'exploitation. Relever légèrement le bout de l'aiguille après l'insertion pour s'assurer qu'on voit bien sa forme sous la peau. Injecter dans le derme 0,1 ml de tuberculine et retirer l'aiguille lentement.
38. Examiner le point d'injection afin de s'assurer que la tuberculine injectée forme une bulle bien visible et perceptible à la palpation. Sinon, soit que l'aiguille était insérée trop profondément ou que la dose était inadéquate. L'administration de tuberculine devrait être reprise du côté opposé.
39. Jeter immédiatement l'aiguille dans un contenant pour objets coupants.
Lecture
40. Après 72 heures (± 6 heures), immobiliser l'animal et confirmer son identification.
41. De 1 main, relever la queue pour étirer légèrement le pli sous-caudal.
42. Examiner et palper le point d'injection sur la longueur du pli sous-caudal avec le pouce et l'index de l'autre main.
43. Consigner les résultats de l'épreuve de TPC pour chaque animal sur le formulaire CFIA/ACIA 1524 comme suit :
- négatif (Nég.) : il n'y a aucun changement visible ou palpable des tissus au point d'injection; ou
- réagissant : il y a un changement visible ou palpable des tissus au point d'injection. Contacter le bureau de district immédiatement.
En cas de doute concernant la nature de la réaction à l'épreuve de TPC, classer l'animal comme réagissant.
44. Les animaux réagissants à l'épreuve de TPC sont soumis à l'épreuve de tuberculination cervicale comparative (TCC) effectuée par un vétérinaire de l'ACIA (consulter la section épreuve TCC).
45. Toutes les épreuves de tuberculine sont officielles et doivent être consignées et transmises au bureau de district de l'ACIA de 1 des façons suivantes :
- remplir le formulaire CFIA/ACIA 1524, y compris la section consacrée aux renseignements sur chaque animal soumis à une épreuve.
Une copie du formulaire CFIA/ACIA 1524 est envoyée au bureau de district responsable de la région où les animaux ont été testés. Une copie doit aussi être jointe au certificat zoosanitaire d'exportation envoyé pour endossement au district (s'il s'agit d'un district différent de celui où les animaux ont été testés) et au certificat pour l'entrée en centre de production de sperme (CFIA/ACIA 1634 – Certificat sanitaire pour l'admission à un centre de production de sperme ou document isolement et autorisation de sortie); ou - remplir en partie le formulaire CFIA/ACIA 1524, comme suit, et joindre la liste des animaux.
- Remplir toutes les sections du formulaire CFIA/ACIA 1524 (à l'exception de la section consacrée aux renseignements sur l'animal), y compris le bloc-signature où le vétérinaire accrédité certifie qu'il ou elle a soumis les animaux décrits à l'épreuve de dépistage à la date et à l'endroit indiqués.
- Joindre au formulaire CFIA/ACIA 1524 la liste de tous les animaux qui ont fait l'objet d'une épreuve de dépistage de la tuberculose et qui ont obtenu un résultat négatif.
À la section du formulaire CFIA/ACIA 1524 consacrée aux renseignements sur l'animal, ajouter l'énoncé suivant : Les (nombre d'animaux) (espèces) figurant sur la liste ont été soumis à l'épreuve à la date et à l'endroit indiqués et ont obtenu des résultats négatifs. Le vétérinaire accrédité devrait signer et dater la liste. - Tous les animaux ayant obtenu des résultats non négatifs à l'épreuve doivent figurer à la section du formulaire CFIA/ACIA 1524 consacrée aux renseignements sur l'animal.
- Une copie du formulaire CFIA/ACIA 1524 complété et la liste jointe sont envoyées au bureau de district responsable de la région où les animaux ont été testés.
Une copie doit aussi accompagner le certificat zoosanitaire d'exportation envoyé pour endossement au district (s'il s'agit d'un district différent de celui où les animaux ont été testés) et le certificat pour l'entrée en centre de production de sperme (CFIA/ACIA 1634 ou document isolement et autorisation de sortie).
Surveillance de l'épreuve de TPC : norme de rendement
46. L'épreuve de TPC présente une spécificité inférieure à l'idéal (variant de 97 % à 99 %), ce qui entraîne un taux de faux positifs de 1 % à 3 % par année dans une population de bétail indemne de la maladie. Les faux positifs indiquent que l'épreuve est réalisée correctement puisqu'en principe l'épreuve donne un certain nombre de faux positifs prévus dans un groupe d'animaux sains.
47. Il existe une norme de rendement minimale pour tous les inspecteurs et vétérinaires, y compris les vétérinaires accrédités qui effectuent les épreuves de TPC. Le taux de réagissants pour chaque vétérinaire accrédité qualifié pour effectuer l'épreuve de TPC doit être surveillé et calculé en fonction du nombre d'épreuves subies par des bovins ou des bisons pour chaque période de 1 an. Si on obtient un taux de réagissants qui est inférieur à la norme de rendement minimale de 1 %, le problème doit être examiné et documenté, tout en prenant les mesures appropriées (c'est-à-dire davantage de formation ou de supervision). Si un nombre insuffisant de bovins/bisons sont testés pendant une période de 1 an pour évaluer la performance du test, cette période sera prolongée.
48. Les vétérinaires de district et les agents vétérinaires participant à l'évaluation des services officiels fournis par les vétérinaires accrédités doivent surveiller les taux de réagissants obtenus par les vétérinaires accrédités. Le non-respect de la norme minimale de rendement observé lors de l'évaluation des services fournis par des vétérinaires accrédités doit être traité conformément au Manuel de procédures de gestion des services vétérinaires accrédités afin d'améliorer les services fournis.
49. Les vétérinaires accrédités peuvent se voir retirer l'autorisation leur permettant d'effectuer l'épreuve de TPC dans le cas où la non-conformité à la norme minimale de rendement ne peut être corrigée.
Épreuve de tuberculination médiocervicale (TMC)
Préparation
50. L'épreuve de TMC est l'épreuve standard officielle pour le dépistage de la tuberculose chez les cervidés. L'épreuve consiste en une injection intradermique de 0,1 ml de tuberculine PPD bovine dans la région médiocervicale avec examen visuel et palpation au bout de 72 heures (± 6 heures) après l'injection.
51. Ne pas réaliser l'épreuve de TMC chez un animal ayant subi une épreuve de tuberculination de quelque nature qu'elle soit au cours des 60 jours précédents.
52. Préparer le matériel suivant :
tuberculine – tuberculine PPD bovine (à entreposer dans un endroit sombre à 4 °C)
seringues – seringues à tuberculine de 1 ml
aiguilles – calibre 26, ⅜ po de long
ouate absorbante
tondeuse électrique avec tête numéro 40
Formulaire CFIA/ACIA 1524 – Rapport d'épreuve intradermique
lampe frontale ou lampe de poche en cas de mauvais éclairage
53. Veiller à ce que la contention de chaque cervidé soumis à l'épreuve soit adéquate pour qu'il soit possible de bien identifier l'animal, préparer le point d'injection, d'injecter la tuberculine avec précision, et d'interpréter correctement les résultats de l'épreuve. Ne pas réaliser ou observer l'épreuve sans que l'animal ne soit correctement immobilisé.
54. Consigner sur le formulaire CFIA/ACIA 1524 l'identification individuelle de chaque animal soumis à l'épreuve. Les méthodes d'identification acceptables d'un animal sont les suivantes : une étiquette approuvée (ou considérée équivalente) sous le Programme d'identification et traçabilité des animaux d'élevage (TRACE), une étiquette d'oreille de la santé des animaux (HofA), un tatouage enregistré ou une étiquette d'oreille approuvée par un organisme provincial qui réglemente les cervidés d'élevage.
Injection
55. Raser à la tondeuse une zone d'environ 8 cm2 dans la région médiocervicale.
56. Nettoyer le point d'injection à la ouate (humectée à l'eau au besoin). Ne pas utiliser d'alcool pour nettoyer le point d'injection. Consigner sur le formulaire CFIA/ACIA 1524 toutes les anomalies, lésions ou croûtes visibles autour du point d'injection pour éviter qu'elles ne soient prises par erreur pour des signes de réaction à la tuberculine.
57. Vérifier l'étiquette de la tuberculine pour confirmer le type – la tuberculine dérivée de M. bovis porte une étiquette orange.
58. Vérifier/confirmer la date de péremption de la tuberculine par rapport à la date actuelle.
59. Désinfecter le bouchon en caoutchouc avec de l'alcool après avoir retiré le sceau en aluminium.
60. Remplir la seringue avec 0,1 ml de tuberculine.
61. Insérer l'aiguille dans le derme de la peau. Relever légèrement le bout de l'aiguille après l'insertion pour s'assurer qu'on voit bien sa forme sous la peau. Injecter dans le derme 0,1 ml de tuberculine et retirer l'aiguille lentement.
62. Examiner le point d'injection afin de s'assurer que la tuberculine injectée forme une bulle bien visible et perceptible à la palpation. Sinon, soit que l'aiguille était insérée trop profondément ou que la dose était inadéquate. Dans un tel cas, l'administration de tuberculine devrait être reprise du côté opposé du cou si possible ou à au moins 15 cm du site d'injection précédent, caudalement ou rostralement.
63. Jeter immédiatement l'aiguille dans un contenant pour objets coupants.
Lecture
64. Examiner et palper le point d'injection 72 heures (± 6 heures) après l'injection. Il est essentiel que l'éclairage soit adéquat.
65. Consigner les résultats de l'épreuve de TMC pour chaque animal sur le formulaire CFIA/ACIA 1524 comme suit :
- négatif (Nég.) : il n'y a aucun changement visible ou palpable des tissus au point d'injection;
- réagissant : il y a un changement visible ou palpable des tissus au point d'injection. Contacter le bureau de district immédiatement.
En cas de doute concernant la nature de la réaction à l'épreuve de TMC, classer l'animal comme réagissant.
66. Tous les animaux classés comme réagissants à l'épreuve de TMC sont soumis à l'épreuve de tuberculination cervicale comparative (TCC) effectuée par un employé de l'ACIA (consulter la section épreuve TCC).
67. Toutes les épreuves de tuberculine sont officielles et doivent être consignées et transmises au bureau de district de l'ACIA de 1 des façons suivantes :
- Remplir le formulaire CFIA/ACIA 1524, y compris la section consacrée aux renseignements sur chaque animal soumis à une épreuve.
Une copie du formulaire CFIA/ACIA 1524 est envoyée au bureau de district responsable de la région où les animaux ont été testés. Une copie doit aussi être jointe au certificat zoosanitaire d'exportation envoyé pour endossement au district (s'il s'agit d'un district différent de celui où les animaux ont été testés); ou - Remplir en partie le formulaire CFIA/ACIA 1524, comme suit, et joindre la liste des animaux.
- Remplir toutes les sections du formulaire CFIA/ACIA 1524 (à l'exception de la section consacrée aux renseignements sur l'animal), y compris le bloc-signature où le vétérinaire accrédité certifie qu'il ou elle a soumis les animaux décrits à l'épreuve de dépistage à la date et à l'endroit indiqués.
- Joindre au formulaire CFIA/ACIA 1524 la liste de tous les animaux qui ont fait l'objet d'une épreuve de dépistage de la tuberculose et qui ont obtenu un résultat négatif.
À la section du formulaire CFIA/ACIA 1524 consacrée aux renseignements sur l'animal, ajouter l'énoncé suivant : les (nombre d'animaux) (espèces) figurant sur la liste ci-jointe ont été soumis à l'épreuve à la date et à l'endroit indiqués et ont obtenu des résultats négatifs. Le vétérinaire accrédité doit signer et dater la liste. - Tous les animaux ayant obtenu des résultats non négatifs à l'épreuve doivent figurer à la section du formulaire CFIA/ACIA 1524 consacrée aux renseignements sur l'animal.
- Une copie du formulaire CFIA/ACIA 1524 complété et la liste jointe sont envoyées au bureau de district responsable de la région où les animaux ont été testés.
Une copie doit aussi accompagner le certificat zoosanitaire d'exportation envoyé pour endossement au district (s'il s'agit d'un district différent de celui où les animaux ont été testés).
Épreuve de tuberculination cervicale comparative (TCC) (pour information seulement. Ces épreuves ne sont pas effectuées par des vétérinaires accrédités)
68. Il est reconnu que la majorité des réacteurs aux épreuves de dépistage TPC et TMC au Canada ne sont pas liés à une infection à la tuberculose bovine. Les épreuves subséquentes de TCC servent à éliminer la majorité des faux réacteurs aux épreuves TPC et TMC et à identifier les animaux réellement infectés. Les épreuves de TCC sont effectuées par des vétérinaires de l'ACIA formés et qualifiés.
69. L'épreuve de TCC consiste en une injection intradermique de 0,1 ml de tuberculine PPD bovine et de 0,1 ml de tuberculine PPD aviaire dans la région cervicale. Cette épreuve est basée sur l'hypothèse selon laquelle M. bovis est quelque peu différent du point de vue antigénique de M. avium et des espèces apparentées. Ainsi, on peut prévoir des réactions différentes chez un hôte après injection simultanée de PPD aviaire et de PPD bovine, selon le type d'infection qui est présente. Un animal infecté par M. bovis présentera une réaction plus importante au point d'injection de la tuberculine PPD bovine qu'à celui de la tuberculine PPD aviaire.
70. Les animaux négatifs à l'épreuve de TCC ne seront pas sujets à d'autres mesures d'investigation.
71. Tout animal ayant un résultat positif à l'épreuve de TCC est considéré suspect de tuberculose et est ordonné à l'abattage (avec compensation financière) pour faire des épreuves de confirmation supplémentaires. Un examen post-mortem détaillé sera effectué, tout tissu anormal sera analysé en laboratoire de même qu'un échantillonnage de tissu d'apparence normale. Si les analyses en laboratoire permettent d'isoler et d'identifier M. bovis, des activités d'éradication seront entreprises à la ferme.
72. Pour des fins d'exportation, même si les réacteurs aux épreuves de TPC et TMC sont confirmés négatifs grâce à l'épreuve de TCC, ces animaux ne sont pas éligibles à l'exportation, mais leur congénères ayant obtenu un résultat négatif aux épreuves TPC ou TMC sont généralement éligibles. Contacter votre vétérinaire de district pour de plus amples informations.
73. Pour que l'épreuve de TCC soit efficace, elle doit être effectuée à un intervalle précis suite aux épreuves de dépistage de TPC ou TMC. Même si cette période d'attente peut représenter un inconvénient pour le producteur, ce délai est préférable au risque de ne pas détecter un animal infecté qui va répandre la maladie. L'épreuve de TCC peut être réalisée comme suit :
- jusqu'à 10 jours après l'injection de l'épreuve de TPC (bovins et bisons seulement);
- pour des fins d'exportation aux États-Unis seulement, l'épreuve de TCC peut aussi être appliquée aux cervidés réagissants à l'épreuve de TMC jusqu'à 10 jours après l'injection de l'épreuve de TMC, dans le but de qualifier les congénères si le résultat de l'épreuve de TCC est négatif;
- au moins 60 jours après l'injection de l'épreuve de TPC (bovins, bisons, moutons, chèvres); ou
- au moins 60 jours après l'injection de l'épreuve de TMC (cervidés).
Toutes les épreuves de TCC ultérieures ne doivent pas être répétées avant au moins 60 jours.
Épreuve de tuberculination post-axillaire simple chez les camélidés
Préparation
74. L'épreuve de tuberculination intradermique à la région post-axillaire est une épreuve standard pour détecter la tuberculose chez les camélidés du Nouveau Monde (lamas, alpagas) et de l'Ancien Monde (chameaux). Bien que cette épreuve ne soit pas validée pour être utilisée dans le cadre d'un programme national de lutte contre la TB, elle est réalisée au Canada dans le cadre de programmes d'exportation et d'importation d'animaux vivants. Pour réaliser l'épreuve, suivre les procédures exposées dans la présente section, à moins que le certificat sanitaire d'exportation n'en dispose autrement.
75. L'épreuve consiste en une injection intradermique de 0,1 ml de tuberculine PPD bovine dans la peau, derrière la région axillaire et le coude de l'animal, avec examen, palpation et mesure au bout de 72 heures (± 6 heures) après l'injection.
76. La réaction à l'épreuve se manifeste par des changements relativement mineurs au niveau de l'épaisseur de la peau, c'est pourquoi il est impératif d'utiliser une méthode très stricte pour réaliser cette épreuve. Les mesures dépendent de la tension de la peau (liée à la position et à la contention de l'animal), de la pression exercée sur la peau par le compas d'épaisseur et de la quantité de peau prise pour faire les mesures. Faire tout ce qui est possible pour normaliser ces conditions lors de l'injection et de la lecture.
77. Remarque : ne pas réaliser cette épreuve chez un animal ayant subi une épreuve de tuberculination de quelque nature qu'elle soit au cours des 90 jours précédents.
78. S'assurer que l'épreuve est réalisée par un vétérinaire accrédité formé et qualifié, en respectant les exigences du pays importateur.
79. Préparer le matériel suivant :
tuberculine – tuberculine PPD bovine (à entreposer dans un endroit sombre à 4 °C)
seringues – seringues à tuberculine de 1 ml
aiguilles – calibre 26, ⅜ po de long
ouate absorbante
tondeuse électrique avec tête numéro 40
compas d'épaisseur
Formulaire CFIA/ACIA 1524 – Rapport d'épreuve intradermique
lampe frontale ou lampe de poche en cas de mauvais éclairage
80. Consigner sur le formulaire CFIA/ACIA 1524 l'identification individuelle de chaque animal soumis à l'épreuve. Les méthodes d'identification acceptables sont les suivantes : une étiquette d'oreille HofA, un tatouage enregistré ou le numéro d'une micropuce si un lecteur est disponible.
Injection
81. Veiller à ce que la contention de chaque animal soumis à l'épreuve soit adéquate pour qu'il soit possible de bien identifier l'animal, de préparer le point d'injection, d'effectuer des mesures précises avant l'injection, d'injecter la tuberculine avec précision, de procéder avec soin à la palpation, et d'effectuer des mesures précises après l'injection.
82. Préparer le point d'injection en rasant à la tondeuse une zone de 8 cm2 sur la face latérale de la paroi thoracique, dans la région axillaire située à proximité du coude.
83. Nettoyer le point d'injection à la ouate (humectée à l'eau au besoin). Ne pas utiliser d'alcool pour nettoyer le point d'injection. Examiner et palper le point d'injection, puis consigner sur le formulaire CFIA/ACIA 1524) toutes les anomalies, lésions ou croûtes visibles autour du point d'injection pour éviter qu'elles ne soient prises par erreur pour des signes de réaction à la tuberculine.
84. Avant d'injecter la tuberculine, relever le pli de la peau située au centre de la zone injection; placer le compas d'épaisseur sur le pli, ajuster le compas de façon à ce qu'il tienne la peau, mais qu'il soit possible de le retirer; retirer le compas d'épaisseur et lire la mesure à 0,5 mm près. Consigner la mesure sur le formulaire CFIA/ACIA 1524.
85. Remarque : effectuer une seule mesure à l'aide du compas d'épaisseur au niveau du point d'injection. Ne pas tenir compte de cette première mesure dans le seul cas où des problèmes sont rencontrés lors de la mesure, il faudra alors répéter toute la procédure. Des mesures répétées entraîneront un « aplatissement » de la peau.
86. Prélever 0,1 ml de tuberculine PPD bovine dans la seringue. Injecter 0,1 ml de tuberculine dans la couche intradermique au centre de la zone injection, en relevant légèrement la pointe de l'aiguille l'injection pour bien voir sa forme juste sous la peau. Retirer lentement.
87. Examiner le point d'injection afin de s'assurer que la tuberculine injectée forme une bulle bien visible et perceptible à la palpation. Sinon, soit que l'aiguille était insérée trop profondément ou que la dose était inadéquate. L'administration de tuberculine devrait être reprise sur l'autre côté dans ce cas.
88. Jeter immédiatement l'aiguille dans un contenant pour objets coupants.
Lecture
89. Examiner et palper le point d'injection sous un bon éclairage au bout de 72 heures (± 6 heures) après l'injection et localiser l'aire où la réaction est la plus importante. Il convient de noter que, chez les camélidés, la réaction au point d'injection est souvent diffuse. La réaction peut être également très variable.
90. Relever le pli de la peau située dans l'aire où la réaction est la plus importante ou à défaut, au centre de la zone injection et mesurer l'épaisseur du pli à l'aide du même compas d'épaisseur utilisé le jour de l'injection et selon la même procédure suivie le jour de l'injection, à 0,5 ml près. Consigner la mesure à 0,5 mm près sur le formulaire CFIA/ACIA 1524.
91. Remarque : effectuer une seule mesure à l'aide du compas d'épaisseur au niveau du point d'injection. Ne pas tenir compte de cette première mesure dans le seul cas où des problèmes sont rencontrés lors de la mesure, il faudra alors répéter toute la procédure. Des mesures répétées entraîneront un « aplatissement » de la peau.
92. Soustraire la valeur de la mesure effectuée avant l'injection de celle de la mesure effectuée après l'injection et consigner la différence sur le formulaire CFIA/ACIA 1524. Cette valeur est la « valeur de la différence d'épaisseur de la peau ».
93. Interpréter la « valeur de la différence d'épaisseur de la peau » conformément aux exigences applicables en matière d'exportation ou d'importation. Si l'interprétation n'est pas spécifiée, classer le résultat de l'épreuve de tuberculination pour chaque animal de la manière suivante et le consigner sur le formulaire CFIA/ACIA 1524 :
- négatif (Nég.) : il n'y a aucune réaction visible ou palpable au point d'injection, et la « valeur de la différence d'épaisseur de la peau » est inférieure à 1,5 mm; ou
- réagissant : il y a une réaction visible ou palpable au point d'injection, ou la « valeur de la différence d'épaisseur de la peau » est égale ou supérieure à 1,5 mm. Contacter immédiatement le bureau de district de l'ACIA.
94. Toutes les épreuves de tuberculine doivent être consignées et transmises au bureau de district de l'ACIA de l'une des façons suivantes :
- remplir le formulaire CFIA/ACIA 1524, y compris la section consacrée aux renseignements sur chaque animal soumis à une épreuve. Une copie du formulaire CFIA/ACIA 1524 est envoyée au bureau de district responsable de la région où les animaux ont été testés. Une copie doit aussi être jointe au certificat zoosanitaire d'exportation envoyé pour endossement au district (s'il s'agit d'un district différent de celui où les animaux ont été testés); ou
- remplir en partie le formulaire CFIA/ACIA 1524, comme suit, et joindre la liste des animaux.
- Remplir toutes les sections du formulaire CFIA/ACIA 1524 (à l'exception de la section consacrée aux renseignements sur l'animal), y compris le bloc-signature où le vétérinaire accrédité certifie qu'il ou elle a soumis les animaux décrits à l'épreuve de dépistage à la date et à l'endroit indiqués.
- Joindre au formulaire CFIA/ACIA 1524 la liste de tous les animaux qui ont fait l'objet d'une épreuve de dépistage de la tuberculose et qui ont obtenu un résultat négatif.
À la section du formulaire CFIA/ACIA 1524 consacrée aux renseignements sur l'animal, ajouter l'énoncé suivant : Les (nombre d'animaux) (espèces) figurant sur la liste ci-jointe ont été soumis à l'épreuve à la date et à l'endroit indiqués et ont obtenu des résultats négatifs. Le vétérinaire accrédité devrait signer et dater la liste. - Tous les animaux ayant obtenu des résultats non négatifs à l'épreuve doivent figurer à la section du formulaire CFIA/ACIA 1524 consacrée aux renseignements sur l'animal.
- Une copie du formulaire CFIA/ACIA 1524 complété et la liste jointe sont envoyées au bureau de district responsable de la région où les animaux ont été testés.
Une copie doit aussi accompagner le certificat zoosanitaire d'exportation envoyé pour endossement au district (s'il s'agit d'un district différent de celui où les animaux ont été testés).
Épreuve de tuberculination à la base de l'oreille chez les porcs
Préparation
95. L'épreuve de tuberculination intradermique à la base de l'oreille est l'épreuve standard pour détecter la tuberculose chez les porcs, réalisée dans le cadre du Programme d'Insémination Artificielle et à des fins d'exportation d'animaux vivants.
96. À moins que le pays importateur ne spécifie des procédures ou une interprétation différentes, utiliser les procédures et l'interprétation exposées dans la présente section.
97. L'épreuve consiste en une injection intradermique de 0,1 ml de tuberculine PPD bovine dans la peau située à la base de l'oreille, avec examen et palpation au bout de 48 heures après l'injection.
98. Remarque : ne pas réaliser cette épreuve chez un animal ayant subi une épreuve de tuberculination de quelque nature qu'elle soit au cours des 60 jours précédents.
99. Veiller à ce que l'épreuve soit réalisée par un vétérinaire accrédité formé et qualifié, en respectant les exigences du pays importateur.
100. Préparer le matériel suivant :
tuberculine – tuberculine PPD bovine (à entreposer dans un endroit sombre à 4 °C)
seringues à tuberculine de 1 ml
aiguilles – calibre 26, ⅜ po de long
ouate absorbante
Formulaire CFIA/ACIA 1524 – Rapport d'épreuve intradermique
lampe frontale ou lampe de poche en cas de mauvais éclairage
101. Veiller à ce que la contention de chaque porc soumis à l'épreuve soit adéquate pour qu'il soit possible de bien lire le numéro d'identification de l'animal, d'injecter la tuberculine avec précision, et d'interpréter correctement les résultats de l'épreuve. La méthode de contention utilisée peut être modifiée en fonction du tempérament et du poids du porc. Ne pas réaliser ou observer l'épreuve sans que l'animal ne soit correctement immobilisé.
102. Consigner sur le formulaire CFIA/ACIA 1524 l'identification individuelle de chaque animal soumis à l'épreuve. Les méthodes d'identification acceptables d'un animal sont mentionnées au Module 2.1 Identification des animaux d'élevage.
Injection
103. Le point d'injection de la tuberculine chez les porcs se situe au niveau de la face dorsale de l'oreille, juste en avant de la base. La tuberculine peut être administrée du côté gauche ou du côté droit, mais l'injection doit être effectuée du même côté chez tous les animaux.
104. Nettoyer la face dorsale de la base de l'oreille à la ouate (humectée à l'eau au besoin). Ne pas utiliser d'alcool pour nettoyer le point d'injection. Consigner sur le formulaire CFIA/ACIA 1524 toutes les anomalies, lésions ou croûtes visibles autour du point d'injection pour éviter qu'elles ne soient prises par erreur pour des signes de réaction à la tuberculine.
105. Vérifier l'étiquette de la tuberculine pour confirmer le type – la tuberculine dérivée de M. bovis porte une étiquette orange.
106. Vérifier/confirmer la date de péremption de la tuberculine par rapport à la date actuelle.
107. Désinfecter le bouchon en caoutchouc avec de l'alcool après avoir retiré le sceau en aluminium.
108. Remplir la seringue avec 0,1 ml de tuberculine.
109. En se tenant de 1 côté du porc, insérer l'aiguille dans le derme de la peau à la base de l'oreille. S'assurer que l'on peut bien voir la forme du biseau de l'aiguille juste sous la peau, puis injecter 0,1 ml de tuberculine et retirer l'aiguille doucement.
110. Examiner le point d'injection afin de s'assurer que la tuberculine injectée forme une bulle bien visible et perceptible à la palpation. Sinon, soit que l'aiguille était insérée trop profondément ou que la dose était inadéquate. L'administration de tuberculine devrait être reprise sur l'autre oreille dans ce cas.
111. Jeter immédiatement l'aiguille dans un contenant pour objets coupants.
Lecture
112. Examiner et palper le point d'injection 48 heures après l'injection. Il est essentiel que l'éclairage soit adéquat.
113. À moins que le pays importateur prévoie une interprétation différente, consigner le résultat de l'épreuve sur le formulaire CFIA/ACIA 1524 comme suit :
- négatif (Nég.) : il n'y a aucun changement visible ou palpable des tissus au point d'injection; ou
- réagissant : il y a un changement appréciable visible ou palpable des tissus au point d'injection.
Aviser le bureau de district de l'ACIA.
114. Il n'existe pas de test comparé auxiliaire disponible. Chaque fois qu'un porcin est classé comme réagissant, il faut mener une enquête afin de déterminer s'il a été en contact avec des ruminants depuis sa naissance. Si c'est le cas, le troupeau auquel appartient le ruminant doit être examiné et soumis à des épreuves par des employés de l'ACIA.
115. Le devenir d'un porcin ayant réagi à l'épreuve est déterminé par les normes du programme dans le cadre duquel l'animal a subi l'épreuve, et il se peut que l'on soumette de nouveau le réagissant à l'épreuve après au moins 60 jours ou qu'on le retire du centre de production de sperme ou de l'envoi destiné à l'exportation.
116. Toutes les épreuves de tuberculine sont officielles et doivent être consignées et transmises au bureau de district de l'ACIA de 1 des façons suivantes :
- Remplir le formulaire CFIA/ACIA 1524 y compris la section consacrée aux renseignements sur chaque animal soumis à une épreuve.
Une copie du formulaire CFIA/ACIA 1524 est envoyée au bureau de district responsable de la région où les animaux ont été testés. Une copie doit aussi être jointe au certificat zoosanitaire d'exportation envoyé pour endossement au district (s'il s'agit d'un district différent de celui où les animaux ont été testés) et au certificat pour l'entrée en centre de production de sperme (CFIA/ACIA 1634 ou document isolement et autorisation de sortie); ou - Remplir en partie le formulaire CFIA/ACIA 1524 comme suit, et joindre la liste des animaux.
- Remplir toutes les sections du formulaire CFIA/ACIA 1524 (à l'exception de la section consacrée aux renseignements sur l'animal), y compris le bloc-signature où le vétérinaire accrédité certifie qu'il ou elle a soumis les animaux décrits à l'épreuve de dépistage à la date et à l'endroit indiqués.
- Joindre au formulaire CFIA/ACIA 1524 la liste de tous les animaux qui ont fait l'objet d'une épreuve de dépistage de la tuberculose et qui ont obtenu un résultat négatif.
À la section du formulaire CFIA/ACIA 1524 consacrée aux renseignements sur l'animal, ajouter l'énoncé suivant : Les (nombre d'animaux) (espèces) figurant sur la liste ci-jointe ont été soumis à l'épreuve à la date et à l'endroit indiqués et ont obtenu des résultats négatifs. Le vétérinaire accrédité devrait signer et dater la liste. - Tous les animaux ayant obtenu des résultats non négatifs à l'épreuve doivent figurer à la section du formulaire CFIA/ACIA 1524 consacrée aux renseignements sur l'animal.
- Une copie du formulaire CFIA/ACIA 1524 complété et la liste jointe sont envoyées au bureau de district responsable de la région où les animaux ont été testés.
Une copie doit aussi accompagner le certificat zoosanitaire d'exportation envoyé pour endossement au district (s'il s'agit d'un district différent de celui où les animaux ont été testés) et le certificat pour l'entrée en centre de production de sperme (CFIA/ACIA 1634 ou document isolement et autorisation de sortie).
3.2 Épreuves sérologiques
Ce module du Manuel du vétérinaire accrédité fournit les renseignements suivants nécessaires aux épreuves sérologiques :
- prélèvement, matériel et fournitures
- préparation et emballage des échantillons de sérum
- laboratoires
- formulaires de soumission
- formulaire papier
- formulaire de soumission numérique avec un système de certification numérique pour l'anémie infectieuse équine (AIE) approuvé par l'Agence canadienne d'inspection des aliments (ACIA)
- procédure particulière pour la soumission dans un laboratoire de l'ACIA d'échantillons provenant de bovins testés en isolement (notification IAI), de moutons/chèvres, des sangliers et des cervidés pour exportation au Mexique et de bovins testés dans le cadre du programme canadien de certification sanitaire des troupeaux à l'égard de la leucose bovine enzootique (PCCST-LBE)
- expédition des échantillons
- critères de rejet dans les laboratoires de santé des animaux de l'ACIA pour les échantillons et les formulaires de soumission
- résultats des épreuves
Objectifs
Selon l'article 2. du Règlement sur la santé des animaux, le terme « épreuve » comprend :
- le prélèvement de tissus ou de liquides d'un animal (par exemple, du sérum);
- une injection pratiquée sur un animal pour déterminer s'il est atteint d'une maladie (par exemple, épreuve à la tuberculine).
La fiabilité d'une épreuve diagnostique est directement liée à la nature des spécimens ou échantillons reçus et à leur état. Le laboratoire doit recevoir un échantillon de bonne qualité.
Prélèvement, matériel et fournitures
Il est très important que les animaux soient correctement identifiés. Les animaux devant subir des épreuves doivent avoir un identifiant unique approuvé pour l'espèce testée. Lorsqu'il n'existe pas d'identificateur approuvé pour les espèces testées, consulter le Module 2.1 Identification des animaux d'élevage ou le Module 2.2 Identification des chevaux pour de plus amples informations.
À moins d'indication contraire, il faut au minimum 1 ml de sérum pour chaque épreuve demandée.
- si vous utilisez des tubes séparateurs de sérum (SST), assurez-vous qu'ils sont centrifugés à une force centrifuge relative (force g) suffisamment élevée (force centrifuge relative de 1100 à 1300) pour que le gel séparateur se mette en place correctement.
- Après la centrifugation, décanter le sérum du tube SST dans un nouveau tube à bouchon rouge avant de l'envoyer au laboratoire.
- le tube SST centrifugé n'empêche pas à lui seul l'hémolyse et la fuite des composants des cellules sanguines du culot vers la fraction de sérum
Il faut envoyer un échantillon distinct pour chaque analyse demandée, même si les différentes épreuves sont effectuées au même laboratoire. Les laboratoires préfèrent des échantillons de sérum séparés afin de préserver l'intégrité de l'échantillon. Par exemple, pour des épreuves de dépistage de brucellose et de leptospirose, il faut 2 échantillons.
Pour le sang coagulé, utiliser :
- des tubes siliconés (à bouchon rouge) – centrifuger avant l'envoi des échantillons et retirer le caillot;
- le sérum devrait être gardé réfrigéré jusqu'à l'envoi;
- des aiguilles à usage unique;
- un marqueur à encre indélébile pour numéroter les ampoules.
Les petits tubes de prélèvement (3 ml) munis ou non d'un capuchon à filet interne sont à éviter, car ils sont sujets aux fuites et peuvent entraîner des problèmes techniques pour le laboratoire.
Les coûts liés au matériel et aux fournitures sont payés par le vétérinaire accrédité.
Préparation et emballage des échantillons de sérum
Inscrire sur chaque ampoule, à l'encre indélébile, le numéro correspondant au numéro inscrit sur le formulaire d'envoi d'échantillons (dans la colonne « Numéro d'ampoule »). Écrire le numéro sur l'ampoule, et non sur le bouchon.
Pour les échantillons pairés du même animal, ils doivent être identifiés avec le même numéro.
- la lettre A sera inscrite pour identifier l'échantillon aigu (le plus vieux) et la lettre C sera inscrite pour identifier l'échantillon convalescent (le plus récent) (par exemple : 001A, 001C, 002A, 002C, 003A, 003C, etc.)
Le vétérinaire accrédité doit s'assurer que les méthodes d'emballage et d'expédition des échantillons sont conformes aux règlements en vigueur pour ce type d'échantillons.
- la majorité des échantillons recueillis dans le cadre du programme des vétérinaires accrédités seront classés comme « spécimens animaux exemptés » en vertu du Règlement sur le transport des marchandises dangereuses.
- les spécimens animaux exemptés sont définis comme « Les échantillons animaux qui ne sont pas présumés contenir des matières infectieuses (par exemple échantillons prélevés à des fins de surveillance ou d'exportation) ou dans lesquels les agents pathogènes ont été neutralisés ou inactivés ».
- pour les échantillons ne répondant pas à cette définition, consultez votre vétérinaire de district pour connaître la classification appropriée et les procédures d'expédition requises.
- Consultez la figure suivant pour connaître les normes à respecter lors de l'expédition d'un spécimen animal exempté.
Liste de contrôle relative aux inscriptions sur l'emballage extérieur
- Nom, adresse et numéro de téléphone de l'expéditeur et du destinataire.
- Les mots – « Spécimen animal exempté » sur l'emballage.
Mentions sur le bordereau d'expédition de l'envoyeur
- Remarque – Spécimen animal exempté
Remarque : si plusieurs contenants primaires fragiles sont placés dans un seul emballage secondaire, il faut qu'ils soient emballés individuellement ou séparés pour empêcher tout contact entre eux.
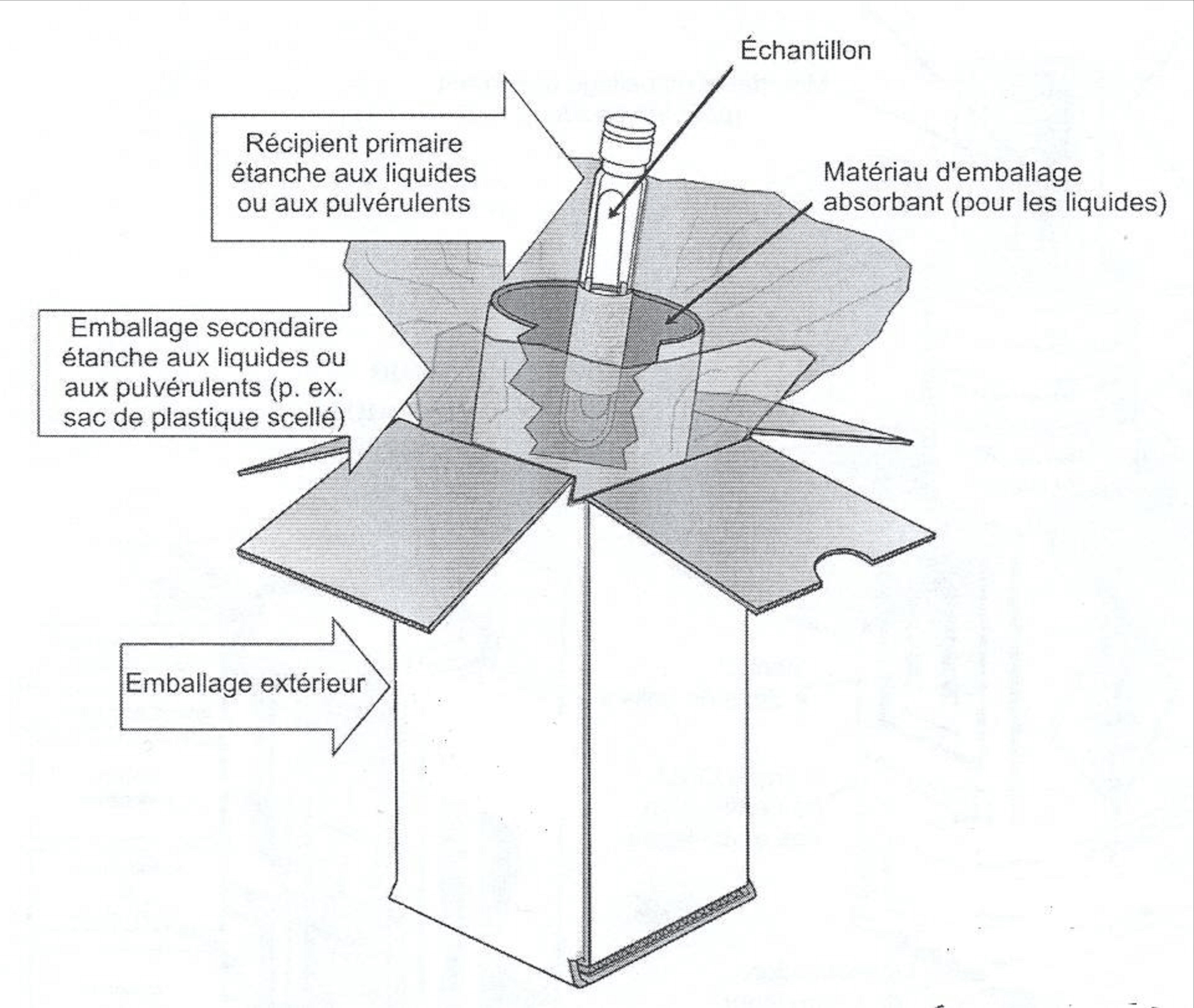
Longue description
Représentation graphique des normes minimale d'emballage d'expédition requises pour les spécimens animaux exemptés
Emballage extérieur
Emballage secondaire étanche aux liquides ou aux pulvérulents (par exemple sac de plastique scellé)
Récipient primaire étanche aux liquides ou aux pulvérulents
Échantillon
Matériau d'emballage absorbant (pour les liquides)
Emballer les ampoules dans des boîtes conçues à cet effet de manière à prévenir les bris (par exemple, utiliser une boîte New York ou une boîte en polystyrène pour l'envoi des ampoules).
- l'utilisation de 1 contenant approprié est une exigence lorsque des échantillons sont soumis au laboratoire.
- l'expéditeur est tenu, légalement aussi bien que moralement, d'assurer la sécurité des personnes manipulant les échantillons au cours du transport et en laboratoire.
Les formulaires de demande d'analyse qui accompagnent les prélèvements doivent être insérés dans une enveloppe qui sera apposée à l'extérieur de l'emballage de protection.
Laboratoires
La plupart des épreuves prévues par la Loi sur la santé des animaux et ses règlements ou exigées expressément par un pays importateur sont réalisées dans un laboratoire de l'ACIA ou un laboratoire approuvé par l'ACIA, à moins d'indication contraire.
Certains laboratoires privés sont spécifiquement approuvés par l'ACIA pour effectuer les épreuves officielles d'anémie infectieuse des équidés (AIE) ou de brucellose soumises par des vétérinaires accrédités.
- ces laboratoires approuvés par l'ACIA (identifiés au Module 3.3 Laboratoires) maintiennent la liste des vétérinaires accrédités pour lesquels ils sont autorisés à accepter les échantillons pour ces épreuves.
- la soumission sera refusée si le vétérinaire n'est pas accrédité pour cette fonction et/ou si le code de l'envoyeur indiqué sur le formulaire de soumission ne correspond pas à celui qui figure dans le dossier du laboratoire approuvé par l'ACIA.
Certains laboratoires privés, même s'ils ne sont pas spécifiquement approuvés par l'ACIA, sont autorisés à effectuer des épreuves pour fin d'exportation.
- lorsque c'est le cas, le manuel du vétérinaire accrédité spécifiera que l'épreuve peut être effectuée dans un laboratoire privé ou autorisé qui rencontre les exigences de la Politique sur le recours aux services d'analyse de laboratoires externes pour la certification des exportations.
- avant de soumettre un échantillon, le vétérinaire accrédité doit vérifier auprès du bureau de district que le laboratoire répond aux exigences requises.
Le vétérinaire accrédité doit assumer les frais d'analyse de laboratoire.
- les frais reliés aux analyses d'échantillons dans un laboratoire de l'ACIA peuvent être consultés au Module 4.2 Droits payables à l'ACIA.
Tous les échantillons soumis à un laboratoire de l'ACIA ou spécifiquement approuvé par l'ACIA doivent être accompagnés d'un formulaire approuvé par l'ACIA pour l'épreuve officielle demandée.
- veuillez contacter le laboratoire approuvé par l'ACIA pour confirmer quelle documentation ou notification est requise lorsqu'un système de certification numérique pour l'AIE approuvé par l'ACIA est utilisé pour soumettre des échantillons (coordonnées disponibles au Module 3.3)
Formulaires de soumission papier
Le vétérinaire accrédité peut se procurer les formulaires nécessaires pour les échantillons soumis aux laboratoires de l'ACIA au bureau de district de l'ACIA.
- lorsque les échantillons sont soumis à un laboratoire de l'ACIA, utiliser le formulaire CFIA/ACIA 5473 – Soumission d'échantillons pour l'importation, l'exportation et l'insémination artificielle.
- les directives sur la façon de transmettre les échantillons sont inscrites sur ce formulaire.
- un numéro de notification de laboratoire, disponible par l'entremise d'un vétérinaire de district de l'ACIA, doit être inscrit dans la section « Motif du test » du formulaire CFIA/ACIA 5473.
- s'assurer que le bon numéro de notification pour les échantillons testés est utilisé.
- pour chaque épreuve demandée, il faut acheminer au laboratoire un prélèvement de sérum et une copie dûment remplie du formulaire approprié.
- une copie du formulaire de soumission doit être conservée en dossier et une copie doit être transmise au bureau de district lors de soumission dans un laboratoire de l'ACIA
Lorsque des échantillons sont soumis pour le dépistage de la brucellose à un laboratoire approuvé par l'ACIA, utiliser aussi le formulaire CFIA/ACIA 5473.
- si les épreuves pour le dépistage de la brucellose sont effectuées à des fins d'exportation, un numéro de notification n'est pas requis sur le formulaire CFIA/ACIA 5473, mais la destination devrait être identifiée comme étant « É.-U. ou Mexique ».
-
il est possible de compléter les 2 premières pages du formulaire CFIA/ACIA 5473 et d'inscrire « voir liste ci-jointe » sur la troisième page.
Cette liste peut être présentée sous forme de tableau dans lequel seront consignés l'identification de l'animal, sa description et les numéros d'ampoules.
- cette liste doit également comporter l'inscription « numéro de référence du formulaire : __________ » et être signée.
- le numéro de référence est celui qui apparaît au milieu en bas de page sur les 3 pages du formulaire CFIA/ACIA 5473 et doit débuter par l'année civil en cours.
- veuillez noter que chaque formulaire 5473 de l'ACIA porte un numéro de référence unique et ne peut être utilisé qu'une seule fois.
- ne faites pas de photocopies de ces formulaires pour un usage ultérieur.
Remarque : pour les échantillons de brucellose prélevés à des fins autres que l'exportation ou le programme d'insémination artificielle (par exemple, avant le déplacement d'espèces zoologiques), veuillez consulter le bureau de district local de l'ACIA pour connaître les procédures de soumission appropriées.
Lorsque les échantillons pour PCCST-LBE sont soumis à un laboratoire de l'ACIA, utiliser le formulaire CFIA/ACIA 3841 – Programme canadien de certification sanitaire des troupeaux – Rapport d'épreuve sérologique
- un gabarit électronique pour la soumission des échantillons PCCST-LBE doit être utilisé au lieu de remplir le tableau d'information sur l'animal du formulaire ACIA 3841.
Les vétérinaires accrédités travaillant dans des cliniques qui ont demandé et obtenu une exemption de la procédure de soumission numérique (se référer au Module 8.4 Anémie infectieuse des équidés), peuvent utiliser le formulaire CFIA/ACIA 3937 – Anémie infectieuse des équidés (AIÉ) – rapport et certificat d'épreuve sérologique pour soumettre des échantillons à un laboratoire approuvé par l'ACIA pour le dépistage de l'AIE. Les formulaires doivent être tapés ou remplis en caractères d'imprimerie et toutes les copies doivent être lisibles.
- inscrire tous les renseignements nécessaires, notamment les numéros des étiquettes d'oreille, des tatouages ou des autres marques d'identification.
- consigner également le type d'épreuve demandée, ainsi que la date et le lieu du prélèvement.
- le vétérinaire accrédité doit inscrire son nom, son adresse (y compris son code postal) et son numéro de téléphone, en plus d'apposer sa signature au bas du formulaire.
- il faut aussi fournir le code de l'envoyeur et le code d'identification du bureau de district de l'ACIA où se trouvent les animaux testés.
Il incombe au vétérinaire accrédité de fournir tous les renseignements demandés.
- les laboratoires peuvent refuser d'analyser les prélèvements qui sont accompagnés de formulaires incomplets.
- il est possible de s'adresser à un vétérinaire de district de l'ACIA pour obtenir des exemples de formulaires remplis et pour des instructions au sujet de la distribution des formulaires devant accompagner les prélèvements envoyés aux laboratoires de l'ACIA.
Formulaire de soumission numérique avec un système de certification numérique pour l'AIE approuvé par l'ACIA
Pour les vétérinaires accrédités travaillant dans des cliniques qui n'ont pas obtenu une exemption de la procédure de soumission numérique, un système de certification numérique pour l'AIE approuvé par l'ACIA doit être utilisé pour soumettre des échantillons aux fins d'épreuve d'AIE à un laboratoire approuvé par l'ACIA.
- L'information à fournir sur le certificat numérique est basée sur celle du formulaire CFIA/ACIA 3937.
- Pour obtenir les coordonnées des fournisseurs offrant ce service, veuillez vous référer à la liste des systèmes de certification numérique pour l'AIE approuvés par l'ACIA (Module 8.4 Anémie infectieuse des équidés).
Le vétérinaire accrédité doit :
- ouvrir un compte chez un fournisseur de service et suivre la formation nécessaire;
- soumettre les échantillons à un laboratoire approuvé par l'ACIA qui a aussi un compte chez ce même fournisseur de service (coordonnées des laboratoires disponibles au Module 3.3);
Pour plus de détails sur les informations et les photographies numériques requises pour l'identification des chevaux, veuillez vous référer au Module 8.4 Anémie infectieuse des équidés.
Les vétérinaires accrédités sont responsables de la sécurité et de l'usage approprié de leur signature numérique, et doivent prendre les précautions nécessaires pour prévenir tout usage inapproprié.
-
seuls les vétérinaires accrédités sont autorisés à utiliser leur signature numérique protégée par mot de passe pour signer des documents.
Les autres membres du personnel de la clinique ne sont pas autorisés à participer au processus de signature. L'utilisation de cette signature numérique par toute autre personne que le vétérinaire accrédité serait considérée comme un manquement important à votre entente d'accréditation, et entraînerait l'annulation du formulaire.
- les critères énumérés à l'article 10 de l'Entente d'accréditation des vétérinaires s'appliquent aussi à la transmission de documents numériques.
Veuillez contacter le laboratoire approuvé par l'ACIA pour confirmer quelle documentation ou notification est requise lorsqu'un système de certification numérique pour l'AIE approuvé par l'ACIA est utilisé pour soumettre des échantillons (coordonnées disponibles au Module 3.3).
Les certificats numériques de test d'AIE approuvés par l'ACIA sont reconnus comme documents de support officiels, et peuvent être consultés en ligne en temps réel par le propriétaire (optionnel), le vétérinaire accrédité, le laboratoire approuvé par l'ACIA et l'ACIA.
- Les copies couleur ou en noir et blanc du certificat numérique de test pour l'AIE approuvé par l'ACIA sont acceptées et peuvent être utilisées pour usage domestique au Canada, ou comme preuve de résultat négatif à l'épreuve d'AIE aux fins d'exportation.
Pour plus de détails sur l'utilisation du système de certification numérique pour l'AIE approuvé par l'ACIA, veuillez contacter le bureau de district de l'ACIA.
Procédure particulière pour la soumission dans un laboratoire de l'ACIA
Cette section s'applique aux échantillons provenant de bovins testés en isolement (notification IAI), de moutons/chèvres, sangliers ou cervidés pour exportation au Mexique et de bovins testés dans le cadre du PCCST-LBE
Quand un vétérinaire accrédité doit soumettre des échantillons pour analyse dans un laboratoire de l'ACIA pour des bovins testés en isolement (IAI), pour exporter des moutons/chèvres, sangliers ou cervidés au Mexique ou pour des bovins testés dans le cadre du PCCST-LBE, un tableur en format Excel doit être complété et envoyé électroniquement en plus de la copie papier du formulaire de soumission (CFIA/ACIA 5473 ou CFIA/ACIA 3841) accompagnant les échantillons.
- Le gabarit pour chaque activité énumérée est disponible auprès du bureau de district de l'ACIA de votre région.
Ce tableur sera utilisé par les laboratoires de l'ACIA pour importer les données dans le Système informatisé pour l'enregistrement et le suivi des analyses de laboratoire (SIESAL). Il permettra d'éviter les erreurs de retranscription et sauvera du temps pour les soumissions contenant un nombre élevé d'échantillons.
Le gabarit doit être complété de la façon qui suit :
- pour chaque soumission, un nouveau gabarit doit être complété.
- on doit s'assurer de le sauvegarder sous un nouveau nom qui contient le numéro de référence du formulaire CFIA/ACIA 5473 auquel il sera associé (par exemple : 2014IEAB-0000079706-4).
- pour les soumissions dans le cadre du PCCST-LBE, le nom du fichier doit contenir le nom de troupeau échantillonnés et la date de l'échantillonnage.
- le fichier Excel nommé correctement doit être acheminé par voie électronique à une adresse générique : cfia.labtemplate-gabaritlab.acia@inspection.gc.ca.
- une copie doit aussi être soumise au bureau de district où les animaux étaient localisés lors du prélèvement.
- chaque gabarit doit être envoyé dans un courriel distinct.
- dans l'objet du courriel, inscrire uniquement le numéro de référence du formulaire CFIA/ACIA 5473 ou le nom du troupeau du PCCST-LBE.
- dans le corps du courriel, mentionner si possible la date d'envoi de l'échantillon.
- aucune colonne ne peut être enlevée ou ajoutée, et le format prescrit doit être suivi.
- autrement, l'importation des données va échouer, entrainant un délai pour l'analyse jusqu'à l'envoi d'un nouveau gabarit.
- les champs obligatoires dans le gabarit incluent le numéro d'échantillon, la date d'échantillonnage, le type d'échantillon, l'identification de l'animal (au minimum un des 6 champs d'identification doit être rempli) et la race.
- indiquer l'âge dans la colonne N.
- si l'âge est inconnu, cette colonne peut être laissée vide à condition de sélectionner dans la liste déroulante « Estimation » à la colonne L et de sélectionner dans la liste déroulante « Non fournie » dans la colonne M.
- quelques champs ne sont pas applicables pour des tests en isolement ou pour l'exportation au Mexique.
- ils ne peuvent être supprimés mais peuvent être laissés vides.
L'adresse courriel générique du laboratoire n'est pas associée à un laboratoire spécifique et ne peut être utilisée pour soumettre des demandes ou questions.
- toute question doit être soumise au bureau de district.
La soumission électronique du gabarit n'annule pas l'obligation de soumettre le formulaire de soumission en format papier avec les échantillons envoyés au laboratoire.
- il est possible de compléter le formulaire de soumission et d'y inscrire « voir liste ci-jointe » dans le tableau d'information sur les animaux.
- la liste peut être une copie du gabarit électronique qui mentionne les numéros d'échantillon, l'identification de l'animal, l'inscription « numéro de référence du formulaire : __________ » et qui est signée.
- ce numéro de référence est celui qui apparaît au milieu en bas de page sur les 3 pages du formulaire CFIA/ACIA 5473.
- pour être acceptable, cette liste jointe doit montrer toute l'information reliée à un animal en particulier sur la même page (utiliser la fonction « masquer » du tableur pour cacher des colonnes non requises), le numéro de référence doit apparaître sur toutes les pages de la liste et chaque page doit être paraphée par le vétérinaire accrédité.
Expédition des échantillons
Joindre tous les formulaires requis aux échantillons.
- Veuillez contacter le laboratoire approuvé par l'ACIA pour confirmer quelle documentation ou notification est requise lorsqu'un système de certification numérique pour l'AIE approuvé par l'ACIA est utilisé pour soumettre des échantillons (coordonnées disponibles au Module 3.3).
Ne jamais confier au propriétaire de l'animal ou à l'exportateur l'envoi des échantillons.
- le vétérinaire accrédité doit être en mesure d'assurer le contrôle des échantillons qu'il expédie aux laboratoires.
- les échantillons à expédier peuvent être regroupés à un emplacement intermédiaire dans un envoi plus important à condition que les échantillons ne soient pas ouverts et/ou réemballés après avoir quitté la possession du vétérinaire accrédité.
Une fois prélevés, les échantillons sont réfrigérés et envoyés au laboratoire sans délai. Il faut donc les faire parvenir au laboratoire par le moyen le plus sûr et le plus rapide.
Envoyer les échantillons qu'en semaine pour éviter qu'ils soient retenus en cours de transport ou que leur analyse soit retardée en laboratoire à cause de la fin de semaine ou d'un congé.
- il est conseillé de n'envoyer les échantillons que du lundi au mercredi, sauf si la réception au laboratoire peut être garantie avant sa fermeture pour la fin de semaine.
- soyez particulièrement attentifs aux fermetures associées aux jours fériés
- si l'envoi est retardé, les échantillons pour l'épreuve d'AIE peuvent être congelés et envoyés à une date ultérieure.
- Consultez le Module 8.4 Anémie infectieuse des équidés au sujet des instructions spécifiques de conservation et de délai d'analyse afin d'assurer la validité des épreuves.
- les échantillons servant aux épreuves d'isolement viral, comme le test à l'immunopéroxydase pour la diarrhée virale bovine (BVD-IP), ne doivent pas être congelés avant d'être expédiés, et doivent être protégés contre les températures extrêmes au cours du transport.
- tout facteur qui influe sur la viabilité de l'agent en question affectera la sensibilité de l'épreuve et par conséquent la fiabilité des résultats.
Lorsque des ampoules se brisent, il faut effectuer un nouveau prélèvement, ce qui retarde sensiblement l'obtention des résultats des épreuves.
Il incombe au vétérinaire accrédité d'envoyer de nouveaux prélèvements lorsque les premiers sont impropres à l'analyse. Les tableaux suivant indique les causes courantes d'échantillons « impropres ».
Le vétérinaire accrédité doit assumer les frais d'expédition.
- si par erreur les échantillons sont envoyés à un laboratoire de l'ACIA n'effectuant pas les analyses demandées, le laboratoire peut, par courtoisie, faire suivre au laboratoire approprié, si le vétérinaire accrédité accepte de défrayer les coûts d'envoi en fournissant son numéro de compte de service de messagerie.
Critères de rejet dans les laboratoires de santé des animaux de l'ACIA pour les échantillons et les formulaires de soumission
L'ACIA et les laboratoires approuvés par l'ACIA doivent respecter les normes d'assurance de la qualité lors de la réception et de l'analyse de tous les échantillons reçus. Les laboratoires approuvés par l'ACIA établissent leurs propres critères internes pour le rejet d'échantillons reçus, et ont des protocoles en place pour informer les envoyeurs du rejet d'échantillons et des raisons de ce rejet. Ces critères peuvent être obtenus directement auprès du laboratoire spécifique approuvé par l'ACIA. Pour les échantillons soumis aux laboratoires de l'ACIA, les critères de rejet sont énumérés dans les tableaux suivant.
Les raisons du rejet peuvent être liées à l'échantillon lui-même ou au formulaire de soumission de l'échantillon. L'avis de rejet des échantillons sera envoyé au vétérinaire accrédité par l'intermédiaire du bureau de district de l'ACIA et comprendra le numéro de référence de la soumission, le(s) numéro(s) d'ampoules(s) des échantillons rejetés (si applicable) et la raison du rejet. En fonction de la raison du rejet, le vétérinaire accrédité devra prendre les mesures correctives appropriées pour le ou les échantillons et/ou pour le formulaire de soumission afin de permettre les tests.
A – général pour tout type d'échantillon
| No. | Critères de rejet pour les échantillons | Résultat sur le Rapport d'analyse (RA) | Commentaires |
|---|---|---|---|
| A1 | Contamination | Impropre |
|
| A2 | Type d'échantillon ou de contenant inadéquat | Impropre |
|
| A3 | Aucun ID sur le contenant de l'échantillon (ampoule/sac) | Impropre |
|
| A4 | Erreur dans un ID | Impropre |
|
| A5 | Échantillon en double | Impropre |
|
| A6 | Échantillon manquant | Aucun échantillon reçu |
|
| A7 | Échantillon excédentaire | Échantillon non testé |
|
| A8 | Ampoule brisée | Brisée sur réception |
|
| A9 | Quantité/Volume Insuffisant | Quantité insuffisante |
|
| A10 | Séries d'échantillons portant le même ID dans une même boîte. | Impropre |
|
B – échantillons de sérologie
| No. | Critères de rejet pour les échantillons | Résultat sur le Rapport d'analyse (RA) | Commentaires |
|---|---|---|---|
| B1 | Lipémie | Impropre |
|
| B2 | Hémolyse | Impropre |
|
| B3 | Caillot de Fibrine (échantillons aviaires) | Impropre |
|
C – échantillons pour l'encéphalopathie spongioforme bovin (ESB)
Remarque : les tests ESB ne sont pas effectués dans le cadre du Programme des vétérinaires accrédités, mais des vétérinaires accrédités peuvent participer au prélèvement de ces échantillons au nom de l'ACIA.
| No. | Critères de rejet pour les échantillons | Résultat sur le Rapport d'analyse (RA) | Commentaires |
|---|---|---|---|
| C1 | Échantillon endommagé | Non testé – Pas d'échantillon soumis |
|
| C2 | Échantillon autolysé | Non testé – Échantillon inadéquat |
|
| C3 | Type inadéquat d'échantillon | Non Testé – Pas d'échantillon soumis |
|
D – autres types spécifiques d'échantillons
Remarque : Ces spécifications s'appliquent aux échantillons prélevés pour les tests de routine et sont un extrait du document Tests et analyses de santé animale effectuées dans les laboratoires de l'ACIA
| No. | Critères de rejet pour les échantillons | Résultat sur le Rapport d'analyse (RA) | Commentaires |
|---|---|---|---|
| D1 | Influenza aviaire | Impropre |
|
| D2 | Paramyxovirus aviaire (maladie de Newcastle) | Impropre |
|
| D3 | Diarrhée virale bovine | Impropre |
|
| D4 | Campylobacter fetus | Impropre |
|
| D5 | Métrite contagieuse équine | Impropre |
|
| D6 | Cysticercose | Impropre |
|
| D7 | Elaphostrongylus cervi | Impropre |
|
| D8 | Embryons obtenus par fécondation in vitro – isolement viral | Impropre |
|
| D9 | Rhinotrachéite infectieuse bovine | Impropre |
|
| D10 | Mycoplasmes | Impropre |
|
| D11 | Salmonellose | Impropre |
|
| D12 | Trichomonose (Tritrichomoniase) | Impropre |
|
| D13 | Rhinotrachéite virale du dindon | Impropre |
|
| D14 | Tous les tests pour Histopathologie (exemple : Cysticercose, TB) | Impropre |
|
Résultats des épreuves
Il incombe au vétérinaire accrédité de communiquer les résultats d'épreuves au propriétaire.
Les résultats des épreuves effectuées dans des laboratoires de l'ACIA sont transmis au moyen du Système informatisé pour l'enregistrement et le suivi des analyses de laboratoire (SIESAL).
- les résultats sont acheminés au vétérinaire accrédité par l'intermédiaire du bureau de district local.
Les résultats des épreuves effectuées dans des laboratoires approuvés par l'ACIA sont habituellement envoyés directement au demandeur et au bureau de district de l'ACIA.
Pour plus de détails sur la distribution des résultats de test lorsqu'un système de certification numérique pour l'AIE approuvé par l'ACIA est utilisé, veuillez vous référer au Module 8.4 Anémie infectieuse des équidés.
Les résultats d'épreuves effectuées dans les laboratoires privés sont habituellement transmis directement au demandeur seulement. Le vétérinaire accrédité fournira à l'ACIA, sur demande, une copie des résultats de ces tests.
Il faut expédier les prélèvements sans tarder pour être assuré de recevoir les résultats en temps voulu.
- les délais d'exécution pour les échantillons testés sont relatifs au jour où les échantillons sont reçus par le laboratoire.
3.3 Laboratoires
Laboratoires approuvés pour le dépistage de l'Anemie infectieuse des équidés (AIÉ) et de la brucellose – Épreuve d'agglutination sur plaque à l'antigène tamponné (BPAT)
Mise à jour :
juin 2025
| Laboratoire Approuvé | AIÉNote de tableau 1 | Bruc. |
|---|---|---|
| Animal Health Center (Serology Laboratory) 1767 Angus Campbell Rd. Abbotsford (Colombie-Britannique) V3G 2M3 Téléphone : 604-556-3135 Télécopieur : 604-556-3133 Personne-ressource : Tracy Roddick Courriel : tracy.rrroddick@gov.bc.ca Courriel labo : serology@gov.bc.ca Personne : Liliana Camargo Courriel : liliana.camargo@gov.bc.ca |
Oui | Oui |
| Antech Diagnostics (Mississauga) 7555 Danbro Crescent Mississauga, ON, L5N 6P9 Téléphone : 905-567-0597 Télécopieur : 905-567-9021 Personne-ressource labo : Kathy Zito Contact : Gregory Freeman Courriel labo : kathy.zito@antechmail.com Courriel : Gregory.Freeman@antechmail.com |
Oui | Non |
| Atlantic Veterinary College Regional Diagnostic Virology Laboratory 550, avenue University Charlottetown (Île-du-Prince-Édouard) C1A 4P3 Téléphone : 902-566-0877 Télécopieur : 902-566-0723 Personne-ressource labo : Dre Carmencita V. Yason 902-566-0752 Contact : Jocelyn Philips Courriel Dr Yason : yason@upei.ca |
Oui | Non |
| Biovet Inc. 4375, avenue Beaudry Saint-Hyacinthe (Québec) J2S 8W2 Téléphone : 450-771-7291 Télécopieur : 450-771-4158971848 Personne-ressource : Amélie Francoeur, poste 971848 Courriel : amelie.francoeur@biovet-inc.com Personne-ressource labo : Annie St.-Germain Courriel : annie.st-germain@biovet-inc.com Personne-ressource AQ : Annie Blier Courriel : annie.blier@biovet-inc.com Laboratoire : poste 971888; Télécopieur : 450-771-2996 |
Oui | Oui |
| Faculté de médecine vétérinaire Service de diagnostic – Université de Montréal 3200, rue Sicotte Saint-Hyacinthe (Québec) J2S 2M2 Téléphone : 450-773-8521, poste 8534 Télécopieur : 450-778-8107 Personne-ressource : Véronique Boyer Courriel : v.boyer@umontreal.ca |
Oui | Non |
| IDEXX Laboratories Canada Corporation (Markham) 1345, rue Denison Markham (Ontario) L3R 5V2 Téléphone : 800-667-3411 Télécopieur : 905-475-7309 Personne-ressource labo : Walter Dew Télephone : 905-968-6288 Courriel : Walter-Dew@idexx.com Personne-ressource : Meghann Bryan Courriel : Meghann-Bryan@idexx.com Autre contacts : Paul Burton Couriel : Paul-Burton@idexx.com |
Oui | Oui |
| Prairie Diagnostic Services Inc. 52, promenade Campus Saskatoon (Saskatchewan) S7N 5B4 Personne-ressource : Anju Tumber : 306-966-7223 Courriel : anju.tumber@pds.usask.ca Personne-ressource : Karen Moline 306-966-1614 Télécopieur : 306-966-7737 Courriel : karen.moline@pds.usask.ca |
Oui | Oui |
| True North Veterinary Diagnostics Inc. 210 – 8063, 199ième rue Langley (Colombie-Britannique) V2Y 0E2 Personne-ressource : Maria Neukamm Courriel : marineukamm@hotmail.com Personne-ressource : Dr Kristyna Musil Courriel : kristyna.musil@truenorthvet.ca Téléphone : 604-539-5550; Télécopieur : 888-336-9408 |
Oui | Non |
| University of Guelph Animal Health Laboratory 419 Gordon Street, édifice 89 Guelph (Ontario) N1G 2W1 Téléphone : 519-824-4120; Télécopieur : 519-821-8072 Personne-ressource labo : Dr Davor Ojkic, poste 54524 Courriel : Dojkic@uoguelph.ca Autre contact : ahl.virology@uoguelph.ca |
Oui | Non |
| Veterinary Diagnostic Services 545, University Crescent Winnipeg, Manitoba R3T 5S6 Téléphone : 204-945-7185; Télécopieur : 204-948-2654 Courriel : Shannon.Kovosec@gov.mb.ca |
Non | Oui |
Laboratoires de l'Agence canadienne d'inspection des aliments
En santé animale, les services de laboratoire de l'Agence canadienne d'inspection des aliments (ACIA) sont assurés par un réseau de centres d'expertise. Chaque élément de ce réseau représente le centre national dans son domaine de spécialisation.
Les centres d'expertise se trouvent dans les laboratoires de l'ACIA suivant :
Laboratoire de l'ACIA – Lethbridge
(Institut de recherche vétérinaire)
225090 Township Road 91
Lethbridge County, Alberta T1J 5R7
Téléphone : 403-382-5500
Télécopieur : 403-381-1202
- Centre d'expertise des maladies virales indigènes des bovins et des équidés
- Centre d'expertise de la fièvre charbonneuse et de la leptospirose
- Centre d'expertise des animaux d'élevage non traditionnels
- Laboratoire de référence de l'Organisation mondiale de la santé animale (OMSA, fondée en tant qu'Office international des épizooties (OIE)) pour la fièvre charbonneuse, l'encéphalopathie spongiforme bovine (ESB) et la diarrhée virale des bovins (DVB)
Laboratoire de l'ACIA – Saskatoon
(Centre de parasitologie alimentaire et animale)
116, route Veterinary
Saskatoon (Saskatchewan) S7N 2R3
Téléphone : 306-385-7824
Télécopieur : 306-385-7866
- Centre de toxi-infections alimentaires et de parasitologie animale
- Centre d'expertise sur les maladies parasitaires du bétail et du gibier d'élevage
- Laboratoire de l'OMSA pour la trichinose
- Centre collaborateur de l'OMSA pour les parasites zoonotiques d'origine alimentaire
Laboratoire de l'ACIA – Winnipeg
(Centre national des maladies animales exotique, Centre scientifique canadien de la santé humaine et animale)
1015, rue Arlington
Winnipeg (Manitoba) R3E 3M4
Téléphone : 204-789-2001
Télécopieur : 204-789-2038
- Centre national des maladies animales exotiques
- Laboratoire de référence de l'OMSA pour l'influenza aviaire et la peste porcine classique
Laboratoire de l'ACIA – Ottawa
3851, route Fallowfield
Ottawa (Ontario) K2J 4S1
Téléphone : 343-212-0500
Télécopieur : 343-212-0204
- Centre d'expertise des maladies aviaires
- Centre d'expertise de la brucellose
- Centre d'expertise du matériel génétique
- Centre d'expertise des maladies mycobactériennes
- Centre d'expertise de la rage
- Laboratoire de référence de l'OMSA pour la rage, la tremblante du mouton et la maladie débilitante chronique des cervidés
Laboratoire de l'ACIA de Saint-Hyacinthe
(Laboratoire d'hygiène vétérinaire et alimentaire)
3400, Boulevard Casavant Ouest
Saint-Hyacinthe (Québec) J2S 8E3
Téléphone : 450-768-6800
Télécopieur : 450-768-6767
- Centre d'expertise des maladies porcines indigènes
- Centre d'expertise de rétrovirologie
3.4 Épreuves pour la détection de la campylobactériose bovine et de la trichomonose
Ce module du manuel du vétérinaire accrédité fournit l'information suivante au sujet des épreuves de campylobactériose bovine et de trichomonose :
Objectifs
Selon l'article 2. du Règlement sur la santé des animaux, le terme « épreuve » comprend :
- le prélèvement de tissus ou de liquides d'un animal (par exemple, du sérum, smegma préputéal)
- une injection pratiquée sur un animal pour déterminer s'il est atteint d'une maladie (par exemple, épreuve à la tuberculine)
La méthode de prélèvement décrite dans ce module peut servir à soumettre des échantillons pour l'exportation (par exemple, pour qualifier des bovins pour exportation au Mexique lorsque requis) ou pour rencontrer les exigences du programme national d'insémination artificielle et le programme d'agrément pour l'exportation des embryons.
Information générale
Tritrichomonas foetus (aussi nommé Trichomonas foetus ou T. foetus) est un parasite protozoaire flagellé qui vit dans le tractus reproducteur des bovins. Il est uniquement transmis par contact vénérien. Les taureaux infectés ont tendance à devenir porteur à vie et servent de réservoir principal de la maladie. Dans le tractus reproductif du taureau, l'organisme se cache communément au niveau des cryptes de la muqueuse pénienne ou préputiale. Tritrichomonas foetus est parfois peu abondant et inégalement distribué dans la cavité préputiale des taureaux infectés.
On pense que la concentration est plus élevée au niveau du gland du pénis. Les vaches qui deviennent infectées peuvent présenter de la mortalité embryonnaire, un avortement spontané, ou souffrir de pyométrite. Certaines vaches demeurent infectées pendant une gestation complète et peuvent transmettre l'infection au début de la saison de reproduction suivante. Même si la prévalence du phénomène des mères porteuses est inconnue, on pense qu'elle est faible.
Campylobacter fetus comprend 2 sous-espèces :
- C. fetus subsp. venerealis
- C. fetus subsp. fetus
Par définition, C. fetus subsp. venerealis est l'agent causal de la campylobactériose génitale bovine, une maladie transmise sexuellement caractérisée par de l'infertilité, une mortalité embryonnaire précoce et de l'avortement. Cette maladie cause des pertes économiques considérables dans les régions où elle est endémique. Même si des infections chez le bovin peuvent aussi être causées par C. fetus subsp. fetus, cet organisme ne cause habituellement que des avortements sporadiques. C. fetus subsp. venerealis est l'organisme d'intérêt pour le programme national d'insémination artificielle, le programme d'agrément pour l'exportation des embryons et la certification à l'exportation de bovins pour le Mexique.
Matériel et fourniture
Les coûts reliés au matériel de prélèvement, d'emballage et d'expédition pour l'envoi des échantillons sont à la charge du vétérinaire accrédité.
Matériel requis :
- gants jetables
- ciseau
- pipette pour infusion ou insémination artificielle de 53 cm (jusqu'à 68 cm pour les gros taureaux) emballée individuellement
- seringue 20 ml jetable
- seringue 3 ml jetable avec aiguille fine (pas plus de 20 gauge)
- milieu de prélèvement et transport pour chaque organisme
Remarque concernant les exigences du milieu de transport : Chaque organisme (Campylobacter et Trichomonas) a des exigences spécifiques de milieu de transport. Présentement, le milieu de collecte et de transport est fourni gracieusement par le laboratoire. Cependant, les frais d'expédition de ces milieux du laboratoire vers le client sont aux frais du client (vétérinaire accrédité ou centre d'insémination artificielle). Un numéro de compte de service de messagerie sera requis lors de la commande de matériel au laboratoire.
- Campylobacter : les fioles de milieu de transport enrichi (MTE) et de saline sont commandées auprès du notre laboratoire de microbiologie et santé animale à Ottawa (Fallowfield)
- un formulaire de commande spécifique est disponible à notre bureau de district.
- le formulaire complété doit être envoyé par courriel au laboratoire (avant la date limite hebdomadaire indiquée sur le formulaire)
- les milieux de transport (MTE) et les fioles de collecte (saline) sont expédiés ensemble dans un contenant de mousse de polystyrène inséré dans un manchon de carton ondulé, qui est placé dans une boîte de mousse de polystyrène de plus grande dimension contenant des blocs réfrigérants
- les milieux ne sont pas expédiés les vendredis
-
si les fioles de MTE devaient se réchauffer durant le transport, ceci ne compromettrait pas leur utilisation ultérieure
Toutefois, dès réception, les milieux MTE et les fioles de collecte (saline) doivent être entreposés à 4 °C jusqu'à leur utilisation
- le contenant de mousse contient 10 fioles de MTE et 6 à 7 fioles de saline
- 2 fioles de MTE sont requises pour chaque animal testé
- le manchon extérieur de chaque contenant de mousse maintient le tout ensemble
- des flèches rouges indiquent la position verticale des fioles
- retirez le manchon de carton pour libérer le contenant de mousse (le dessus de chaque contenant de mousse est identifié en anglais et en français)
- retirez le dessus du contenant pour accéder aux fioles de MTE et de saline
- vérifier qu'il y a bien une étiquette (fixée sur chacune des fioles) et une date d'expiration (écrite sur l'étiquette)
- toutes les fioles de MTE doivent avoir une étiquette et être inoculées au plus tard à la date d'expiration mentionnée pour être acceptées pour culture
- les fioles de MTE ont une durée de conservation de 90 jours après la date de production
- milieu de transport pour Trichomonas foetus (TFTM) : le milieu de transport provient du Centre de parasitologie alimentaire et animale de notre laboratoire à Saskatoon
- un formulaire de commande spécifique est disponible auprès de notre bureau de district.
- le formulaire complété doit être envoyé par courriel au laboratoire (avant la date limite hebdomadaire indiquée sur le formulaire) pour la commande de milieux.
- ce milieu de transport doit aussi être entreposé à 4 °C dès sa réception, jusqu'à son utilisation
- sa durée de conservation est de 14 jours suivant sa date de production
- le milieu peut être inoculé jusqu'à la date d'expiration inclusivement
Remarque sur la commande de milieux de transport : communiquez avec notre bureau de district bien à l'avance de tout échantillonnage planifié. Bien que les commandes puissent généralement être expédiées au demandeur dans les 5 jours suivant la réception de la demande, l'état de l'inventaire actuel (par exemple, date d'expiration imminente) ou les commandes de quantités importantes peuvent nécessiter la production d'un nouveau lot de milieux, ce qui peut prendre jusqu'à 6 semaines.
Échantillonnage
Une bonne technique de prélèvement et de la minutie lors de l'entreposage et de l'envoi sont déterminants pour obtenir une sensibilité optimale du test diagnostique. Une vidéo produite par notre laboratoire à Saskatoon est disponible à notre bureau de district pour visualiser la technique de prélèvement pour Tritrichomonas.
Les dates d'échantillonnage doivent être choisies en tenant compte du temps d'expédition au laboratoire.
Les échantillons doivent arriver au laboratoire au plus tard le jeudi et ne doivent pas être expédiés pendant la fin de semaine, car ils doivent être reçus par le laboratoire dans un certain délai suite à l'inoculation du milieu (48 heures pour Campylobacter ; 5 jours pour Tritrichomonas).
Lors de l'échantillonnage, tous les milieux de transport (MTE et TFTM) et le milieu de collecte (saline) doivent être amenés à une température ambiante de 18 à 37 °C avant leur inoculation.
- la date d'expiration du milieu de transport doit être vérifiée avant de débuter la prise d'échantillon
- 2 échantillons distincts doivent être prélevés si le dépistage pour les 2 organismes est requis
- la contention de l'animal est requise pour éviter des blessures à celui-ci ainsi qu'à la personne qui effectue la collecte
- du matériel de prélèvement distinct doit être utilisé pour chaque animal
mâles :
- un échantillon de liquide préputial (smegma) est prélevé.
- l'échantillonnage ne peut être effectué que 7 jours après un service naturel ou la récolte de sperme à l'aide d'un vagin artificiel
- l'utilisation de nouveaux gants jetables est requise entre chaque animal
- les longs poils et les amas de fèces à l'entrée du fourreau doivent être coupés à l'aide de ciseaux pour diminuer la contamination
- on doit prendre soin de désinfecter puis rincer les ciseaux entre chaque animal
- il n'est pas conseillé de laver le prépuce, puisque le lavage peut introduire des contaminants et/ou rincer et éliminer les organismes ciblés
- tout désinfectant doit être évité.
- Si la région préputiale est excessivement sale, un nettoyage minutieux à l'eau de la partie externe seulement peut être effectué, suivi d'un assèchement à l'aide de serviette de papier
- insérer la pipette dans le fourreau jusqu'à la moitié de la gaine préputiale
- connecter une seringue de 20 ml et appliquer une pression négative.
- maintenir la pipette parallèle au fourreau
- si on est inquiet d'introduire des contaminants lors du passage de l'orifice préputial, la gaine de plastique qui recouvre la pipette peut demeurer en place jusqu'à ce que la partie la plus contaminée à l'entrée du fourreau soit dépassée
- avancer la pipette jusqu'au fornix
- à l'aide de mouvement de va-et-vient allant du fornix jusqu'à 5 cm de l'entrée du fourreau, glisser la pipette 10 à 15 fois pour effectuer un délicat grattage de la muqueuse préputiale
- il est important que la pipette entre en contact avec le gland du pénis
- le grattage sera recueilli grâce à la pression négative dans la pipette
- retirer la pipette et la seringue du prépuce
femelles :
- le mucus cervical ou des écoulements vaginaux doivent être prélevés
- utiliser une paire de gants jetables distincts entre chaque animal
- la vulve externe est nettoyée de ses débris à l'aide de serviettes en papier légèrement mouillées
- éviter l'utilisation de désinfectant
- immobiliser le col par palpation transrectale et introduire la pipette dans le tiers antérieur du vagin
- avancer la pipette jusqu'au col.
- Une pression négative est appliquée à l'aide de la seringue pour prélever du mucus cervical
- des sécrétions vaginales peuvent aussi être collectées dans le vagin antérieur
- une fois le matériel prélevé, retirer la seringue et la pipette de la vulve
Préparation de l'échantillon et emballage
La fiabilité d'une épreuve diagnostique est directement liée à la nature des spécimens ou aux échantillons reçus et à leur état. Il est très important de bien identifier les animaux et de fournir des renseignements complets et exacts sur les formulaires.
Chaque fiole doit porter une inscription à l'encre indélébile, correspondant au numéro inscrit sous la colonne nombre d'ampoule du formulaire de soumission attribué à l'animal échantillonné.
Pour l'analyse de Campylobacter, 2 fioles doivent être identifiées avec le même numéro qui correspond à l'animal testé
Tritrichomonas :
- identifier correctement les fioles de transport TFTM (étiqueter le tube actuelle avec l'identificateur, pas seulement le couvercle)
- expulser tout le matériel récolté dans la fiole
- Aspirer doucement du milieu de transport dans la pipette et rincer à répétition tout contenu résiduel de la seringue et de la pipette dans le milieu de transport
- remettre les fioles de transport TFTM contenant les échantillons dans leur contenant isolé ayant servi à leur envoi par le laboratoire
- les spécimens inoculés doivent être emballés pour prévenir l'exposition à la lumière et minimiser les variations de température
- pour prévenir les variations de température pendant l'expédition, les échantillons mis dans un contenant isolé seront emballés à l'aide de papier journal ou de tout autre matériel isolant pour combler les espaces vides
- les échantillons doivent être conservés entre 10 à 37 °C.
- Si les échantillons sont conservés et expédiés à 4 °C ou moins, la viabilité des organismes diminue et la sensibilité du test diminuera
- l'utilisation de contenant isolé est essentielle
- les échantillons gelés ou expédiés sur la glace ne donneront pas de résultats fiables et de nouveaux échantillons seront requis
- lors des mois d'été, des précautions doivent être prises pour éviter que les échantillons soient exposés à des températures excédant 37 °C.
- n'ajoutez pas de blocs réfrigérants, car cela fera chuter la température des échantillons en dessous de 10 °C
- lors des mois d'hiver, des blocs/sacs de gel peuvent être réchauffés à un maximum de 37 °C et être ajoutés à l'envoi pour maintenir les échantillons au-dessus de 10 °C.
- ne placez pas ces matériaux en contact direct avec les échantillons et précisez sur le formulaire de demande que ces blocs/sacs de gel supplémentaires n'ont pas été congelés, mais inclus dans l'emballage à la température ambiante ou en dessous de la température maximale indiquée ci-dessus
- les échantillons doivent parvenir au laboratoire de Saskatoon dans les 5 jours de la collecte, sinon ils seront déclarés impropres et ne seront pas analysés
Campylobacter :
- identifier correctement 2 fioles MTE et 1 fiole de saline
- ouvrez la fiole de saline
- recueillir un échantillon de liquide préputial tel que décrit plus haut
- immerger l'extrémité de la pipette dans la saline et y transférer l'échantillon
- expulser le matériel résiduel en aspirant de la saline et en rinçant délicatement à plusieurs reprises à l'aide du piston
- l'échantillon ne doit pas demeurer dans la saline plus de 15 minutes avant le transfert et l'inoculation dans les fioles de milieu de transport MTE
- utiliser une seringue stérile jetable de 3 ml et une aiguille fine (au plus 20 gauge) et aspirer délicatement 2 ml de la couche supérieure de saline
- évacuer tout l'air de la seringue avant le transfert
- les bouchons des fioles de MTE sont couverts par un morceau de ruban adhésif
- soulever l'extrémité libre du ruban adhésif pour exposer la membrane en caoutchouc du bouchon (ne pas dévisser le bouchon des fioles de MTE, car cela pourrait modifier la composition du mélange gazeux qu'elles contiennent)
- injecter 1 ml de saline aspirée à travers la membrane de caoutchouc dans la fiole MTE
- replacer le ruban adhésif sur la membrane de caoutchouc
- ne pas injecter la saline directement à travers le ruban adhésif
- répéter l'opération pour la deuxième fiole de MTE, en utilisant le 1 ml de la saline restant dans la seringue
- mélangez le contenu en agitant délicatement les fioles de MTE
- replacer les fioles MTE et les fioles de saline usagées dans la partie inférieure du contenant de mousse d'où elles avaient été retirées
- quand le contenant de mousse est rempli de fioles de MTE et saline, replacez le couvercle du contenant et glisser le manchon de carton ondulé par-dessus, avec les flèches rouges pointant vers le haut
- placer le contenant de mousse dans une autre boîte de mousse de polystyrène plus grande sans bloc réfrigérant et retourner le tout à notre laboratoire à Ottawa (Fallowfield) sans délai
- la température pendant le transport devrait se situer entre 18 à 37 °C
- l'utilisation de blocs/sacs de gel réchauffés devrait être envisagée pendant les mois les plus froids, tel que décrit ci-dessus pour Tritrichomonas
- utiliser le mode de transport disponible qui est le plus rapide et sécuritaire, et envoyer les échantillons en semaine seulement pour éviter qu'ils soient retenus en transit ou mis en attente au laboratoire pendant les fins de semaine ou lors de journées fériées
- les fioles de MTE doivent parvenir au laboratoire de diagnostic dans les 48 heures suivant leur inoculation
- les échantillons qui arrivent au laboratoire après ce délai seront déclarés impropres à être analysés
- les échantillons doivent être protégés contre les températures extrêmes pendant leur transport
- chaque facteur influençant la viabilité de l'organisme recherché affectera la sensibilité du test effectué, compromettant la fiabilité du résultat d'analyse
- si les échantillons arrivent au laboratoire froids ou congelés, ils seront déclarés impropres et ne seront pas analysés
Formulaires de soumission
Les échantillons doivent être soumis à l'aide du formulaire CFIA/ACIA 5473 et du gabarit Excel correspondant.
- les 2 sont disponibles auprès notre bureau de district.
- voir la section « Procédures spéciales pour la présentation aux laboratoires de l'ACIA » du module 3.2 pour plus de détails.
Une copie du formulaire de soumission dûment rempli est envoyée au bureau de district, et pour chaque épreuve demandée, il faut acheminer au laboratoire une copie qui accompagne chaque échantillon.
Les formulaires doivent être soigneusement remplis. Toutes les copies doivent être lisibles.
Y inscrire tous les renseignements nécessaires, notamment ceux figurant sur les étiquettes d'oreille, les tatouages et les autres marques d'identification.
Consigner également le type d'épreuve demandée, ainsi que la date et le lieu du prélèvement.
Le vétérinaire accrédité doit inscrire son nom, son adresse (y compris son code postal) et son numéro de téléphone, en plus d'apposer sa signature au bas du formulaire.
Il faut aussi fournir le code de l'expéditeur et le code d'identification de notre bureau de district où se trouvent les animaux.
Un numéro de notification de laboratoire, qui est disponible par l'entremise d'un vétérinaire de district, doit être inscrit dans la section « Motif du test » du formulaire CFIA/ACIA 5473.
- le laboratoire ne procédera pas à l'analyse si le numéro de notification est manquant
Il incombe au vétérinaire accrédité de fournir tous les renseignements demandés ou d'envoyer de nouveaux prélèvements lorsque les premiers ne satisfont pas aux exigences du laboratoire pour les épreuves demandées.
- les laboratoires peuvent refuser d'analyser les prélèvements qui sont accompagnés de formulaires qui ne sont pas remplis correctement
Vous pouvez vous adresser au vétérinaire de district pour obtenir des exemples de formulaires remplis et pour vous informer au sujet de la distribution des formulaires devant accompagner les prélèvements envoyés à nos laboratoires.
Expédition des échantillons
Il est essentiel que les prélèvements soient acheminés au laboratoire approprié dans les délais exigés pour éviter les répercussions sur l'intégrité des échantillons et une potentielle reprise des échantillons.
- en cas de doute, consulter le vétérinaire de district avant d'expédier les échantillons.
Lorsque des ampoules se brisent, il faut effectuer un nouveau prélèvement, ce qui retarde significativement l'obtention des résultats des épreuves.
- l'expéditeur est tenu, légalement aussi bien que moralement, d'assurer la sécurité des personnes manipulant les échantillons au cours du transport et au laboratoire.
C'est pourquoi l'utilisation d'un emballage approprié est exigée pour l'acheminement de prélèvements à un laboratoire.
Le vétérinaire accrédité doit s'assurer que les méthodes d'emballage et d'expédition des échantillons sont conformes aux règlements en vigueur pour ce type d'échantillons.
Les formulaires de demande d'analyse qui accompagnent les prélèvements doivent être insérés dans une enveloppe qui sera ensuite apposée à l'extérieur de l'emballage de protection.
Ne jamais confier au propriétaire de l'animal ou à l'exportateur l'envoi des échantillons.
- le vétérinaire accrédité doit être en mesure d'assurer le contrôle des échantillons qu'il expédie aux laboratoires
Le vétérinaire accrédité doit assumer les frais d'expédition.
Laboratoires
Les échantillons pour l'analyse de Campylobacter sont expédiés à notre laboratoire à Ottawa (Fallowfield).
Les échantillons pour l'analyse de Tritrichomonas doivent être expédiés à notre laboratoire à Saskatoon.
La liste de nos laboratoires est fournie au module 3.3 Laboratoires, à titre de référence.
Résultat des épreuves
Les résultats des épreuves effectuées dans nos laboratoires sont transmis au moyen du Système informatisé pour l'enregistrement et le suivi des analyses de laboratoire (SIESAL).
Les résultats sont acheminés au vétérinaire accrédité par l'intermédiaire du bureau de district local.
Le vétérinaire accrédité est responsable d'aviser le propriétaire du résultat.
Frais d'analyse de laboratoire
Le vétérinaire accrédité doit assumer les frais d'analyse de laboratoire.
Le bureau de district va facturer les frais applicables pour toute épreuve effectuée dans notre laboratoire, quel que soit le résultat de l'épreuve.
L'avis sur les prix de l'ACIA peut être consulté pour de plus amples informations.
3.5 Test de génotype pour la sensibilité à la tremblante
Ovins
L'analyse du génotype du gène prion a été déterminée comme étant un facteur significatif de la susceptibilité à l'infection par la tremblante classique chez les ovins. Il y a plus de chances de découvrir la maladie chez les ovins dans les génotypes présentant la plus grande susceptibilité (voir le tableau 1).
Le patrimoine génétique des ovins, comme celui de tous les mammifères, est constitué d'organismes diploïdes. Toutes les cellules contiennent 2 copies de chaque chromosome, et donc, 2 copies du gène qui code pour la protéine prion. Les gènes sont constitués de codons, un segment d'ADN qui détermine quel acide aminé particulier sera inclus à un endroit particulier d'une protéine (dans ce cas, la protéine prion). La protéine prion est composée de 256 acides aminés, il y a donc 256 codons déterminant ces acides aminés dans le gène de la protéine prion (PRNP).
Des études menées dans diverses régions géographiques et auprès de différentes races d'ovins ont révélé que 3 codons sont liés de façon plus significative à la susceptibilité à la tremblante classique : 136, 154 et 171. Les génotypes d'ovins au Canada sont désignés en utilisant ces numéros de codons et les 2 allèles correspondants associés au codon. Par exemple, 136 AV; 154 RR; 171 QR (également appelé ARQ/VRR en abrégé). En Amérique du Nord, on accorde une importance primordiale aux codons 136 et 171 en association avec la sensibilité à la tremblante classique.
Le profil du génotype prion d'ovins varie selon les pays, les troupeaux et les races. Bien qu'aucun génotype ne confère une résistance absolue à l'infection par la tremblante, la présence d'arginine (R) au codon 171 confère un niveau élevé de résistance à la tremblante classique. Inversement, la présence de glutamine (Q) au codon 171 est associée à la sensibilité. Ceci est confirmé par le fait que parmi tous les moutons diagnostiqués avec la tremblante classique au Canada de 1998 à 2008, 93% étaient du génotype ARQ/ARQ, et plus de 98% étaient homozygotes 171QQ. De même, la majorité des cas de tremblante classique signalés dans le monde entier concernaient des moutons 171QQ.
Bien que rares dans la population ovine canadienne, l'histidine (H) ou la lysine (K) peuvent également se trouver au codon 171, mais toutes 2 sont actuellement considérées comme équivalentes à 171Q en termes de sensibilité.
L'acide aminé valine (V) au codon 136 confère une plus grande susceptibilité parmi la population 171QR. Le tableau 1 résume la sensibilité relative des génotypes ovins à la tremblante classique.
| Génotype (136, 171) | Sensibilité à la tremblante classique |
|---|---|
| AA, RR | Négligeable |
| AA, QR | Très faible |
| AV, QR | Intermédiaire |
| AA, QQ AV, QQ VV, QQ |
Élevée |
Une découverte importante, en ce qui concerne la transmission de la tremblante, est que le génotype du fœtus influence la migration et l'accumulation de prions anormaux dans le placenta d'une brebis infectée. Une brebis infectée par le gène 171QQ portant un fœtus 171QQ entraîne l'accumulation de grandes quantités de prions anormaux, qui sont ensuite éliminés lors de la naissance ou de l'avortement. Cependant, lorsqu'une brebis infectée par la tremblante porte un fœtus 171QR ou 171RR, le prion anormal ne passe pas du côté fœtal du placenta. L'utilisation d'un bélier 171RR pour la reproduction peut donc prévenir l'excrétion du prion anormal à l'agnelage par les brebis infectées.
La connaissance de la résistance génétique à la tremblante classique a conduit à la mise en œuvre de programmes d'élevage dans plusieurs pays qui visent à réduire la sensibilité des troupeaux nationaux. Bien que la promotion intensive de l'utilisation de béliers 171RR à travers le Canada puisse être efficace pour minimiser la propagation de la tremblante, elle entraînerait également un changement significatif du profil génotypique du troupeau national. Actuellement, les données démographiques de la population ovine du Canada montrent une variation considérable des profils génotypiques de la tremblante entre les races et les troupeaux.
La sélection pour la résistance à la tremblante est un outil efficace de contrôle de la maladie qui peut être appliqué par les propriétaires. À ce jour, la sélection de génotypes résistants à la tremblante n'a pas été associée à des traits de production négatifs.
Il faut noter que la tremblante atypique ne suit pas la même association avec le génotype que celle décrite pour la tremblante classique et qu'elle a été détectée dans de nombreux pays, principalement par le biais de tests sur les animaux morts et de programmes de surveillance active de la tremblante. Bien que l'on parle maintenant de tremblante atypique, les cas étaient initialement appelés Nor98, car le premier cas a été identifié en Norvège en 1998. La tremblante atypique semble être cliniquement, pathologiquement, biochimiquement et épidémiologiquement sans rapport avec la tremblante classique et ne constitue donc pas un risque connu de propagation puisqu'elle est limitée à cet animal individuel.
Chèvres
Au cours des dernières années, l'ACIA a évalué les preuves de la résistance génétique à la tremblante classique chez les chèvres. Les données génotypiques obtenues de plusieurs troupeaux de chèvres infectés par la tremblante au Canada, combinées aux résultats des recherches en cours en Amérique du Nord et en Europe, fournissent des preuves convaincantes de la résistance génétique chez les chèvres.
L'ACIA travaille actuellement à l'incorporation de l'utilisation des allèles de résistance génétique S146 et K222 chez les chèvres dans notre Programme national d'éradication de la tremblante (PNES) au Canada. Cette démarche est conforme à celle de nos partenaires commerciaux, les États-Unis (US) et l'Union européenne (UE). À l'échelle internationale, d'autres pays touchés par la tremblante (y compris les États-Unis) ayant des programmes d'éradication ont commencé à utiliser ces produits dans leurs programmes nationaux.
D'autres recherches dans le contexte canadien sont encore nécessaires pour les génotypes de chèvres et la résistance à la tremblante, et seront effectuées par le biais d'un projet pilote visant à évaluer la résistance à la tremblante dans les troupeaux de chèvres positifs.
Procédures d'échantillonnage pour le génotypage
Les échantillons prélevés pour le génotypage aux fins du Programme national de certification des troupeaux à l'égard de la tremblante (PCTT) ou pour l'exportation vers les États-Unis doivent être prélevés par un vétérinaire accrédité. Des identifiants approuvés sont requis sur les moutons faisant l'objet d'un génotypage et le numéro d'identification officiel (15 chiffres) doit être inclus dans la soumission de l'échantillon.
Ponction veineuse jugulaire
Pour faciliter le prélèvement rapide d'échantillons sanguins sur plusieurs moutons en un minimum de temps, il est suggéré de ne pas perdre de temps à relever les moutons. Immobilisez les moutons pour la ponction veineuse en position debout.
Tout en bloquant l'orifice supérieur du thorax, trouver par palpation ou par approximation l'emplacement de la veine jugulaire et y introduire l'aiguille du Vacutainer.
Pour chaque animal, on utilisera une aiguille uniservice afin d'éviter la contamination croisée d'ADN.
Prélever de 7 à 10 ml de sang dans un tube (à bouchon lilas ou violet) contenant de l'acide éthylènediaminetétracétique (EDTA).
S'assurer que les paramètres d'identification de l'échantillon et de l'animal correspondent de manière irréfutable.
Les échantillons doivent être conservés à 4 °C jusqu'à leur expédition. Les envoyer au laboratoire le plus tôt possible.
Le Module 3.2 de ce manuel fournit des instructions détaillées sur l'emballage, l'expédition et la soumission des échantillons sérologiques.
Les échantillons collectés dans le cadre du Programme de certification des troupeaux (PCTT)à l'égard de la tremblante doivent être soumis à un laboratoire figurant dans l'annexe G du Module 7.5 de ce manuel.
Les échantillons collectés en vue d'une exportation vers les États-Unis doivent être soumis au National Veterinary Services Laboratory (NVSL) ou à un autre laboratoire désigné par le NVSL pour vérifier le génotype. Sélectionnez "Ovine PrP Genotyping" sur le lien – (en anglais seulement) pour accéder aux informations du laboratoire.
Échantillons de tissus alternatifs
L'analyse du génotype peut être effectuée sur des tissus autres que le sang total, à condition que le laboratoire agréé ait été évalué et approuvé pour l'analyse du type de tissu soumis (par exemple, une biopsie de la peau). Il incombe au vétérinaire accrédité de confirmer quelles analyses de tissus sont offertes dans le cadre des fonctions du laboratoire agréé.