Le contenu suivant fournit des conseils aux vétérinaires bovins sur la collecte et l'emballage des échantillons pour les tests de l'ESB dans le cadre du programme de surveillance de l'ESB.
Consultez les informations sur le programme national de surveillance de l'ESB.
Sur cette page
- 1. Procédures de prélèvement d'échantillons
- 2. Préparation et soumission des échantillons
- 3. Les procédures de décontamination des prions
1. Procédures de prélèvement d'échantillons
1.1. Précautions sanitaires
Protégez vos yeux, votre nez, votre bouche et vos mains de tout contact direct involontaire avec le tissu cérébral.
1.2. Considérations relatives à la qualité des échantillons
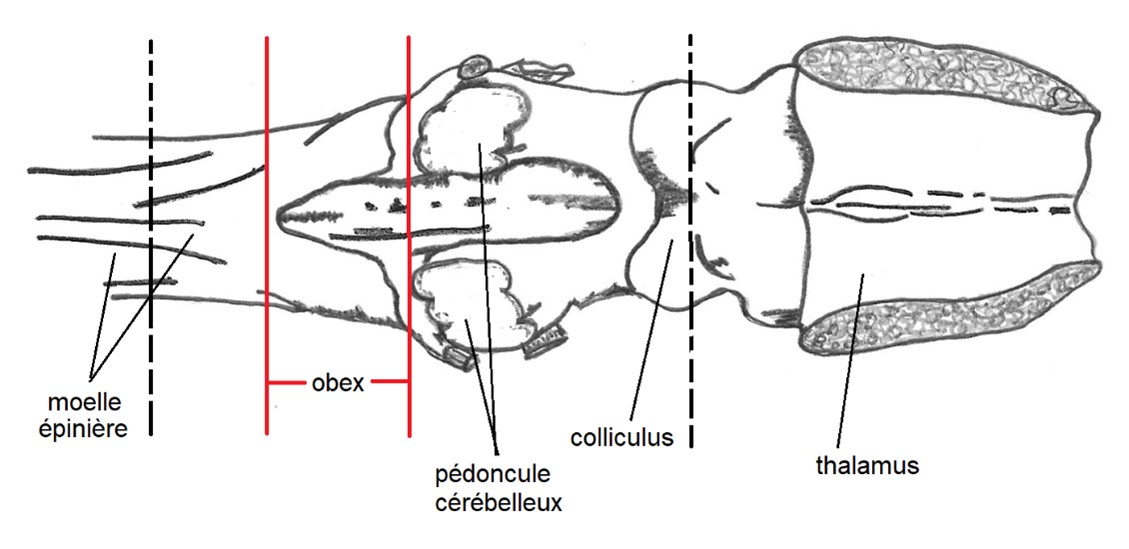
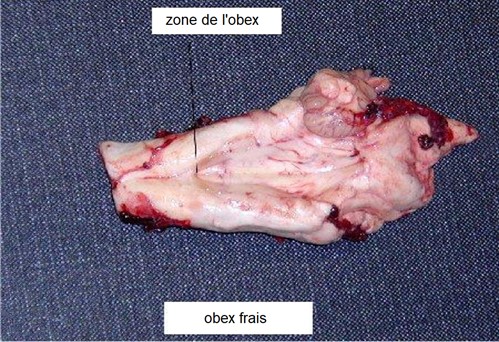
L'échantillon idéal est le tronc cérébral avec un obex clairement visible.
À éviter :
- autolyse (pourrissement) du tissu cérébral
- plusieurs cycles de congélation-décongélation ou réfrigération prolongée
- manipulation brutale lors de l'échantillonnage et de l'expédition
- prélèvement sans l'obex
- prélèvement en plusieurs parties
Bonnes pratiques :
- prélevez les échantillons frais et les conserver au réfrigérateur pendant une courte période
- expédiez-les rapidement au laboratoire de l'ESB sur des blocs de glace
- évitez de congeler le tronc cérébral ; si un délai est prévu, congeler à -20 °C ou moins.
1.3. Désarticulation de la tête
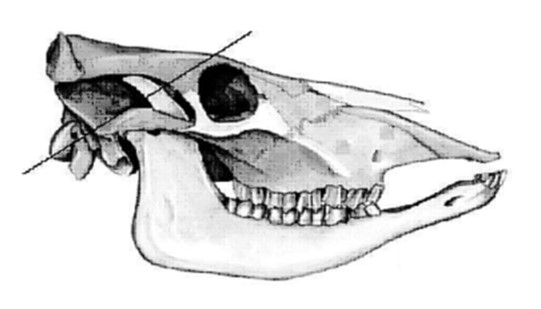
Seule la désarticulation appropriée de la tête au niveau de l'articulation atlanto-occipitale pour exposer le foramen magnum permettra de prélever correctement tronc cérébral contenant l'obex. Si la désarticulation se produit au niveau d'une autre articulation, il sera très difficile d'accéder à l'obex sans l'endommager.
1.4. Identification de l'obex
Ces images illustrent la portion du tronc cérébral à prélever en utilisant l'une des techniques décrites dans la section 1.5, afin de garantir qu'elle inclut l'obex.
1.5. Techniques de collecte d'échantillons
- 1.5.1. Technique de la cuillère
- 1.5.2. Technique de la spatule
- 1.5.3. Technique d'extraction du cerveau entier
1.5.1. Technique de la cuillère
Pour réaliser cette technique, les outils suivants sont nécessaires :
- pince dents de rat
- paire de ciseaux mayo
- cuillère destinée à l'ablation de l'obex
- réceptacle primaire
- papier essuie-tout
- marqueur indélébile
- Étiquetez le réceptacle primaire avec l'identifiant unique (IU) à l'aide d'un marqueur indélébile puis mettez-le de côté
- À l'aide du couteau post-mortem, désarticulez la tête de la carcasse au niveau de l'articulation atlanto-occipitale et sectionnez transversalement la moelle épinière
- Placez la tête désarticulée sur la table, face dorsale vers le bas, avec le foramen magnum face à vous
- Avec la pince et les ciseaux, pratiquez une incision le long de la dure-mère, de façon à former 2 rabats
- Maintenez la dure-mère avec la pince pour exposer les nerfs crâniens sortant de la moelle épinière
- Sectionnez les nerfs crâniens de la moelle épinière (il s'agit de l'étape la plus importante pour libérer la moelle épinière et faciliter l'ablation de l'obex à l'aide de la technique de la cuillère)
- Insérez la cuillère, la face vers le bas, dans le foramen magnum
- Faites avancer la cuillère vers l'avant de sorte que la pointe vienne se loger entre le cervelet et le tronc cérébral/la moelle épinière
- En poussant vers le bas avec la cuillère, faites un mouvement de va-et-vient par-dessus la moelle épinière afin que celle-ci se sépare du reste du cerveau
- Utilisez la cuillère pour tirer doucement le tronc cérébral/la moelle épinière sectionné(e) par le foramen magnum
- Placez le tronc cérébral dans le réceptacle primaire pour le soumettre au dépistage
- Si nécessaire, nettoyez l'extérieur du réceptacle primaire sans abîmer l'étiquette.
- Suivez les mesures de décontamination appropriées
2.5.2. Technique de la spatule
Pour réaliser cette technique, les outils suivants sont nécessaires :
- couteau post-mortem
- pince dents de rat
- paire de ciseaux mayo
- couteau à cerveau
- spatule
- réceptacle primaire
- papier essuie-tout
- marqueur indélébile
- Étiquetez le réceptacle primaire avec l'IU à l'aide d'un marqueur indélébile puis mettez-le de côté
- À l'aide du couteau post-mortem, désarticulez la tête de la carcasse au niveau de l'articulation atlanto-occipitale et sectionnez transversalement la moelle épinière
- Placez la tête désarticulée sur la table, face dorsale vers le bas, avec le foramen magnum face à vous
- À l'aide de la pince et des ciseaux, retirez la dure-mère par l'ouverture du foramen magnum pour exposer le canal médullaire
- Insérez le couteau à cerveau dans la cavité crânienne, dans le sens rostral, à travers le foramen magnum
- Veillez à ce que la lame du couteau soit parallèle à la surface dorsale du tronc cérébral et en position ventrale par rapport au cervelet, puis déplacez le couteau dans un mouvement de tranchage d'un côté à l'autre jusqu'à ce que la pointe touche l'os
- Tournez la lame du couteau et écartez délicatement le cervelet
- Retirez le couteau
- Veillez à ce que la lame de la spatule soit orientée latéralement, puis insérez la spatule dans le foramen magnum
- Poussez la lame dans le sens rostral jusqu'à ce que le manche de la spatule pénètre d'environ 2 tiers dans la cavité crânienne (cela correspondra au niveau de la jonction ponto-mésencéphalique)
- Tournez la lame dans le sens ventral et dorsal pour sectionner le tronc cérébral
- Saisissez l'extrémité caudale du tronc cérébral à l'aide de la pince dents de rat
- Tirez doucement la spatule et la pince vers le caudal pour provoquer l'ablation du tronc cérébral
- Placez le tronc cérébral dans le réceptacle primaire pour le soumettre au dépistage
- Si nécessaire, nettoyez l'extérieur du réceptacle primaire sans abîmer l'étiquette
- Suivez les mesures de décontamination appropriées
2.5.3. Technique d'extraction du cerveau entier
Lorsqu'il est impossible de soumettre l'obex à l'analyse, il est recommandé de soumettre l'ensemble du cerveau.
L'ablation de l'ensemble du cerveau nécessite les outils suivants :
- couteau post-mortem
- scie post-mortem
- burin
- ciseaux
- réceptacle primaire
- papier essuie-tout
- marqueur indélébile
Remarque : n'utilisez pas de hache pour ouvrir le crâne.
- Étiquetez le réceptacle primaire avec l'IU à l'aide d'un marqueur indélébile puis mettez-le de côté
- À l'aide du couteau post-mortem, désarticulez la tête de la carcasse au niveau de l'articulation atlanto-occipitale et sectionnez transversalement la moelle épinière
- Placez la tête désarticulée sur la table. La tête devrait être placée face dorsale vers le haut
- Incisez la peau de la zone frontale afin de pouvoir peler la zone où seront pratiquées les incisions avec la scie (voir la figure 3)
- Retirez la peau circonscrite et les oreilles des os du crâne
- À l'aide du couteau, tracez grossièrement 3 lignes pour délimiter le morceau du crâne qui devra être enlevé en le sciant le long des lignes (voir la figure 4)
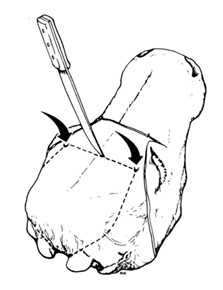
- À l'aide de la scie post-mortem, pratiquez une incision allant d'un foramen supraorbitaire à l'autre (voir la figure 5), d'environ 2 cm de profondeur et inclinée en direction caudale
- Faites 2 autres coupes de chaque côté du crâne depuis le milieu du foramen magnum, parallèlement aux bords latéraux du foramen, jusqu'à un point situé à 2 cm du bord de l'orbite, inclinées d'environ 45 degrés vers l'intérieur (voir la figure 6)
- Insérez un couteau lourd ou un burin dans la première incision et écartez le haut du crâne en direction caudale
Veillez à ce que les méninges attachées ne perturbent pas la substance cérébrale, en particulier les méninges situées entre les hémisphères cérébraux et en avant du cervelet; les ciseaux sont plus appropriés qu'un couteau pour couper ces membranes. - Coupez le pédoncule olfactif et soulevez légèrement le cerveau pour pouvoir sectionner le nerf optique
Lorsque le cerveau est soulevé, la tige pituitaire devient visible. Coupez le pédoncule en laissant la glande pituitaire dans sa fosse osseuse. - Soulevez doucement le cerveau vers le haut et vers l'arrière, alors coupez les racines des nerfs crâniens
Cela permet au cerveau, ainsi qu'à un segment d'environ 4 centimètres de la moelle épinière cervicale, d'être libérés de la cavité crânienne - Placez le cerveau dans le réceptacle primaire pour le soumettre au dépistage
- Si nécessaire, nettoyez l'extérieur du réceptacle primaire sans abîmer l'étiquette
- Suivez les mesures de décontamination appropriées

2. Préparation et soumission des échantillons
Une liste de contrôle reprenant toutes les étapes, de la préparation à l'emballage et à l'expédition de l'échantillon, se trouve à la section 2.4.
2.1. Préparation et emballage des échantillons
Les échantillons requis doivent être soumis à l'état frais (dans la mesure du possible). La congélation de l'échantillon (à -20 °C ou moins) ne doit être utilisée que si un délai de plusieurs jours est prévu entre le prélèvement de l'échantillon et son arrivée au laboratoire de l'ESB.
Il est essentiel que tous les échantillons soumis soient accompagnés de l'IU généré par l'outil en ligne pour les candidats à la surveillance de l'ESB. Un échantillon sans IU ne sera pas traité au laboratoire.
L'IU est composé de lettres minuscules et de chiffres aléatoires. Par exemple : 0jm2bjtivl, où le première caractère est le chiffre 0 et le dernier est la lettre minuscule « l » (comme dans « lion »).
2.2. Emballage de l'échantillon
Un emballage adéquat est essentiel pour protéger les spécimens ainsi que les personnes qui manipulent les colis.
-
Réceptacle primaire : contenant qui contient le tissu cible
Il doit s'agir d'un contenant étanche tel qu'un sac d'échantillonnage Whirl-Pak® ou un contenant en plastique dur muni d'un couvercle hermétiqueLe réceptacle primaire doit porter l'IU indiqué en permanence sur le contenant à l'aide d'un marqueur indélébile.
-
Contenant secondaire : contenant qui contient 1 ou plusieurs réceptacles primaires
Le contenant secondaire devrait également être étanche et contenir un matériau absorbant capable d'absorber le contenu liquide du réceptacle primaire, ainsi qu'un bloc de glace congelé pour maintenir l'échantillon au frais pendant le transport.Le contenant secondaire doit porter l'IU indiqué en permanence sur le contenant à l'aide d'un marqueur indélébile.
- Emballage extérieur : l'emballage extérieur contient le contenant secondaire et doit porter les inscriptions suivantes :
- nom, adresse et numéro de téléphone de l'expéditeur et du destinataire
- mention « Le identifiant unique (IU) : »
- mention « Spécimen animal exempté »
- mention « Numéro d'urgence 24 heures sur 24 : 613-239-4604 »
2.3. Expédition d'échantillons
Une déclaration indiquant que cet échantillon est un spécimen animal exempté devrait être ajoutée à la feuille de route de l'expéditeur.
Tous les échantillons destinés au dépistage de l'ESB doivent être envoyés au laboratoire le plus proche participant aux tests de l'ESB.
2.4. Liste de contrôle pour la préparation, l'emballage et l'expédition d'échantillons pour le dépistage de l'ESB
- La carcasse ou la partie de carcasse est accompagnée d'un IU (sinon, ne pas prélever ni expédier l'échantillon)
- Le tissu cible (obex) se trouve dans l'échantillon à soumettre
- L'échantillon n'est pas autolysé
- L'échantillon est emballé dans un réceptacle primaire étanche
- Le réceptacle primaire est désigné par l'IU de manière permanente
- Le réceptacle primaire se trouve à l'intérieur d'un contenant secondaire
- Le contenant secondaire contient le(s) récipient(s) primaire(s), un matériau absorbant (par example papier essuie-tout) et des blocs de glace congelés
- L'emballage extérieur porte toutes les inscriptions nécessaires :
- nom, adresse et numéro de téléphone de l'expéditeur et du destinataire;
- mention « Le identifiant unique (IU) : »
- mention « Spécimen animal exempté »;
- mention « Numéro d'urgence 24 heures sur 24 : 613-239-4604 »
- La feuille de route de l'expéditeur indique qu'il s'agit d'un spécimen animal exempté
- L'échantillon est expédié au laboratoire le plus proche participant aux tests de l'ESB ou 1 bureau de district de l'ACIA est contacté pour organiser la collecte
3. Les procédures de décontamination des prions
Pour gérer le risque d'exposition aux prions de l'ESB lorsque vous prélevez des échantillons de cerveau, protégez vos yeux, votre nez, votre bouche et vos mains de tout contact direct involontaire avec le tissu cérébral. Cette mesure vise à prévenir l'exposition à des prions qui pourraient entraîner une transmission effective de l'ESB à l'être humain, et est propre aux propriétés potentiellement nocives de l'agent de l'ESB.
Utilisez de l'hypochlorite de sodium (NaOCl) ou de l'hydroxyde de sodium (NaOH) pour décontaminer le matériel/les instruments et les surfaces de travail de la manière suivante :
- Hypochlorite de sodium (NaOCI) à une concentration de 2 % de chlore actif disponible
Cela peut être préparé à partir d'eau de Javel de qualité industrielle ou disponible dans le commerce (par exemple, Javex). Diluez l'eau de Javel de sorte à obtenir une concentration finale de 2 % (20 000 ppm) de chlore disponible. Par exemple, l'étiquette de la plupart des agents de blanchiment disponibles dans le commerce indique une concentration de 6 % de chlore disponible. Dans ce cas, il faut mélanger 1 partie d'eau de Javel et 2 parties d'eau (rapport de 1:2) pour obtenir la concentration de 2 % de chlore disponible. - Hydroxyde de sodium (NaOH) à une concentration de 2 moles
Le produit peut être acheté sous forme de cristaux auprès de Fisher Scientific. Pour faire une concentration de 2 moles de NaOH, il faut diluer 80 grammes de cristaux de NaOH dans 1 litre d'eau, en s'assurant de bien mélanger.
Les surfaces et le matériel devraient être mouillés (ou trempés) avec du NaOCl ou du NaOH pendant au moins 1 heure à 20 °C.
Remarque : d'autres désinfectants tels que le Virkon ne sont pas efficaces contre les prions de l'ESB.
Instruments destinés à l'élimination
Les instruments destinés à être éliminés peuvent comprendre des articles tels que des scalpels jetables. Avant l'élimination :
- incinérer à 850 °C; ou
- essuyer propre, tremper dans du NaOCl à 2 % de chlore disponible ou dans du NaOH à 2 moles pendant 1 heure à 20 °C, puis jeter comme déchets domestiques; ou
- essuyer propre, passer à l'autoclave à 134 °C pendant 1 heure, puis jeter comme déchets domestiques
Le papier essuie-tout servant à essuyer les instruments constitue un déchet solide.
Instruments destinés à la réutilisation
Les instruments et le matériel destinés à la réutilisation devraient être maintenus humides entre le moment de l'exposition aux matières infectieuses et la décontamination subséquente.
- Pour les instruments réutilisables qui ne sont pas sensibles à la chaleur, il faut
- essuyer propre et passer à l'autoclave à 134 °C pendant 1 heure; ou
- essuyer propre, tremper dans du NaOCl à 2 % de chlore disponible ou dans du NaOH à 2 moles pendant 1 heure, rincer à l'eau, transférer dans de l'eau et passer à l'autoclave à 121 °C pendant 1 heure
- Pour les instruments réutilisables sensibles à la chaleur, il faut :
- essuyer propre, tremper dans du NaOH à 2 moles pendant 1 heure à 20 °C et rincer à l'eau
Surfaces
Nettoyez soigneusement, inondez les surfaces avec du NaOCl à 2 % de chlore disponible ou du NaOH à 2 moles pendant 1 heure à 20 °C, et rincez à l'eau pour éviter tout dommage potentiel dû à la nature caustique du NaOCl et du NaOH.
Déchets solides (équipement de protection individuelle jetable, rebuts, etc.)
- Incinérer à 850 °C; ou
- Passer à l'autoclave à 134 °C pendant 1 heure; ou
- Passer à l'hydrolyse alcaline dans un récipient sous pression à 150 °C
Une fois la décontamination terminée, jetez comme déchets domestiques.
Déchets liquides
- Incinérer à 850 °C; ou
- Passer à l'autoclave à 134 °C pendant 1 heure; ou
- Mélanger dans une solution de 2 % de chlore disponible pendant une heure
Une fois la décontamination terminée, jetez comme des déchets domestiques.