Sur cette page
- 1. Objectif
- 2. Méthodes d'échantillonnage
- 3. Préparation de l'expédition
- 4. Normes de laboratoire concernant les tests et leurs résultats
- 5. Méthodes d'analyse
1. Objectif
La présente annexe fournit des informations visant à aider les entreprises alimentaires à prélever et à préparer les échantillons dans le cadre du programme de surveillance de la vérification des procédé (PSVP) pour d'E.coli de type générique dans la volaille crue.
À vous de choisir!
Vous pouvez utiliser d'autres méthodes d'échantillonnage et de test mis au point par des gouvernements provinciaux, des associations de l'industrie, des partenaires internationaux ou des organismes universitaires. Assurez-vous de faire évaluer votre proposition par L'Agence canadienne d'inspection des aliments (ACIA) quant à son équivalence avec les pays étrangers.
Ce qui n'est pas inclus!
Bien que le présent document fournisse des détails spécifiques concernant l'échantillonnage d'E. coli dans la volaille, il ne décrit pas les pratiques exemplaires générales pour l'échantillonnage. Veiller à consulter également le document « Procédures d'échantillonnage ».
2. Méthodes d'échantillonnage
2.1 Considérations clés concernant l'échantillonnage
- Tenir compte de la sensibilité au facteur temps des échantillons.
Pour obtenir les résultats les plus précis, le laboratoire doit analyser les échantillons dans les 24 heures suivant leur prélèvement.
Lorsque cela n'est pas possible (p. ex., les jours fériés ou les week-ends), effectuer le prélèvement de la carcasse, procéder à une réfrigération contrôlée et expédier l'échantillon au laboratoire uniquement lorsque les analyses peuvent être garanties dans les 24 heures suivant leur prélèvement.
- Échantillons adéquats : température
Le laboratoire n'analysera pas les échantillons qui sont congelés (moins de 0 °C) ou trop chauds (température supérieure à 10 °C pour le rinçage).
Si les échantillons ont besoin d'être expédiés hors site, s'assurer qu'ils sont conservés à une température de réfrigération jusqu'au moment du transport, et qu'ils sont réfrigérés pour leur expédition au laboratoire effectuant l'analyse. Éviter d'entreposer les contenants d'expédition près de radiateurs ou à des endroits exposés à une chaleur excessive. Éviter de congeler les échantillons.
- Se préparer à l'échantillonnage : vérifier que tout le matériel est adapté.
- Préparer et étiqueter, si nécessaire, le matériel d'échantillonnage avant le prélèvement.
- Envisager de placer le matériel dans un fourre-tout qui contiendra également les fournitures nécessaires à la désinfection de la station d'échantillonnage.
- Vérifier le milieu d'échantillonnage : jeter toutes les solutions de diluant au phosphate de Butterfield (DPB) qui sont troubles, turbides ou contiennent des particules.
Réfrigérer les solutions 24 heures avant de les utiliser.
- S'assurer que les gabarits sont stériles et secs. Les gabarits peuvent être réutilisables ou non. Ils peuvent être fait de métal, d'une feuille de papier d'aluminium, de papier brun, de plastique souple, etc.
- Disposer d'un moyen de contrôler l'échantillon, tel qu'un sceau inviolable, dès que le prélèvement est terminé.
Remarque : de l'eau peptonée tamponnée (EPT) stérile peut remplacer le diluant au phosphate de Butterfield (DPB); cependant, il peut y avoir une légère augmentation du nombre de bactéries suite à ce changement (augmentation de ¼ log). Si un critère de vérification du procédé (CVP) a été publié pour la méthode d'échantillonnage employée, il n'est pas permis de modifier les valeurs limites de résultat marginal (« m ») ou inacceptable (« M »).
2.2 Méthode de rinçage des carcasses pour toutes les espèces de volaille autres que le dindon et l'oie
Matériel d'échantillonnage
- gants stériles;
- 2 sacs stériles de 3 500 millilitres (ml) de type Stomacher ou autoscellables, ou l'équivalent, suffisamment grands pour contenir la carcasse pendant le rinçage;
- 400 ml de diluant au phosphate de Butterfield (DPB) stérile et prérefroidi.
- attaches en plastique de type « tie wraps », ou l'équivalent, pour fermer les sacs;
- facultatif : récipient stérile étanche.
Prélèvement des échantillons
- Appliquer les techniques aseptiques décrites dans le document « Procédures d'échantillonnage ».
- Sélectionner l'échantillon, au moment choisi de façon aléatoire.
- Déterminer l'étape du procédé à laquelle les carcasses seront prélevées pour l'échantillonnage : les carcasses sont à sélectionner dans la zone après refroidissement, une fois que toutes les interventions ont eu lieu et après un temps d'égouttage suffisant.
- Sélectionner une carcasse, puis compter 5 carcasses en amont ou en aval et sélectionner la carcasse suivante pour l'échantillonnage (sélection aléatoire, sans biais).
- Si la sixième carcasse n'est pas celle d'un oiseau entier dont la peau est intacte, compter 5 autres carcasses en amont ou en aval pour la sélection de l'échantillon.
- Répéter l'opération jusqu'à ce qu'une carcasse entière soit disponible.
- Dans les établissements où l'emplacement final de la chaîne d'égouttage rend dangereux le retrait d'une carcasse d'une chaîne en mouvement, prélever l'échantillon à la sortie du refroidisseur, directement depuis le convoyeur à courroie, tout en s'assurant que le temps d'égouttage est suffisant.
- Si l'emplacement de l'intervention antimicrobienne finale est temporairement changé en raison d'un événement imprévu (p. ex., défaillance d'équipement), sélectionner une carcasse après l'étape d'intervention finale alternative.
- Prendre la carcasse choisie au hasard :
- Ouvrir le sac d'échantillonnage sans en toucher l'intérieur stérile.
Ne laisser rien d'autre que la carcasse échantillonnée toucher l'intérieur du sac d'échantillonnage.
- Mettre des gants stériles.
- Saisir l'extérieur du fond du sac et pousser vers le haut de façon à former une espèce de « gant ».
- Saisir la carcasse par les pattes; laisser s'écouler l'excès de liquide afin de prévenir la dilution du produit de rinçage (p. ex., égouttage d'au moins 1 minute) en prenant soin d'éviter la contamination croisée.
- Utiliser l'autre main pour rabattre le sac sur la carcasse en ne touchant que la surface extérieure.
- Ouvrir le sac d'échantillonnage sans en toucher l'intérieur stérile.
- Préparer l'échantillon
- Placer le sac contenant la carcasse sur la surface plane désinfectée.
- Ouvrir le récipient contenant le DPB et verser le DPB sur la carcasse qui est dans le sac.
- Manipuler la peau lâche du cou pour en recouvrir les os du cou à travers le sac.
- Expulser l'excédent d'air du sac et le fermer en tordant son extrémité et en rabattant la partie torsadée.
- Tout en tenant fermement le sac fermé, rincer la carcasse à l'intérieur et à l'extérieur en effectuant un mouvement de balancier pendant environ 1 minute.
Ainsi, on s'assure que l'intérieur et l'extérieur de la carcasse sont rincés.
- Placer le sac contenant le poulet sur la surface plane désinfectée, le haut du sac tourné vers le haut.
- Enlever le bouchon à vis du récipient à échantillon stérile et placer le bouchon dans le petit sac stérile refermable.
- Ouvrir le grand sac contenant le poulet et verser 30 ml de DPB du sac dans le récipient à échantillon stérile.
- Retirer le bouchon à vis du petit sac refermable et fermer le récipient à échantillon.
- S'assurer que le bouchon est correctement vissé et ne pas trop le serrer.
- Placer le récipient à échantillon dans le deuxième sac refermable, en chassant l'excès d'air.
- Jeter le liquide restant.
- Replacer le poulet dans le réservoir de refroidissement ou à l'endroit où il a été prélevé.
Petit conseil
L'échantillonnage peut également être effectué par 2 personnes portant des gants stériles :
- 1 personne pour tenir le sac ouvert;
- 1 personne pour saisir la carcasse et verser le DPB.
2.3 Méthode de rinçage pour les carcasses de dindon et d'oie
Remarque : la participation d'un assistant est recommandée pour l'échantillonnage.
Matériel d'échantillonnage
- gants stériles;
- 2 sacs stériles de 3 500 ml de type Stomacher ou autoscellables, ou l'équivalent, suffisamment grands pour contenir la carcasse pendant le rinçage;
- les sacs mesurent environ 18 pouces sur 24 pouces;
- les dindons de grande taille devraient être placés dans un sac à autoclave en polypropylène transparent d'environ 24 pouces sur 30 à 36 pouces;
- 600 ml de diluant au phosphate de Butterfield (DPB) stérile et prérefroidi;
- attaches en plastique (tie wrap) ou élastiques épais, ou l'équivalent, au besoin pour fermer les sacs d'échantillonnage;
- facultatif : récipient stérile et étanche.
Prélèvement des échantillons
- Appliquer les techniques aseptiques décrites dans le document « Procédures d'échantillonnage ».
- Sélectionner l'échantillon, au moment choisi de façon aléatoire.
- Déterminer l'étape du procédé à laquelle les carcasses seront prélevées pour l'échantillonnage : les carcasses sont à sélectionner dans la zone après refroidissement, une fois que toutes les interventions ont eu lieu et après un temps d'égouttage suffisant.
- Sélectionner une carcasse, puis compter 5 carcasses en amont ou en aval et sélectionner la carcasse suivante pour l'échantillonnage (sélection aléatoire, sans biais).
- Si la sixième carcasse n'est pas celle d'un oiseau entier dont la peau est intacte, compter 5 autres carcasses en amont ou en aval pour la sélection de l'échantillon.
- Répéter l'opération jusqu'à ce qu'une carcasse entière soit disponible.
- Dans les établissements où l'emplacement final de la chaîne d'égouttage rend dangereux le retrait d'une carcasse d'une chaîne en mouvement, prélever l'échantillon à la sortie du refroidisseur, directement depuis le convoyeur à courroie.
- Si l'emplacement de l'intervention antimicrobienne finale est temporairement changé en raison d'un événement imprévu (p. ex., défaillance d'équipement), sélectionner une carcasse après l'étape d'intervention finale alternative.
- Prendre la carcasse choisie au hasard :
- L'assistant ouvre le sac d'échantillonnage sans en toucher l'intérieur stérile.
Ne laisser rien d'autre que la carcasse échantillonnée toucher l'intérieur du sac d'échantillonnage.
- Mettre des gants stériles.
- Saisir la carcasse par les pattes; laisser s'écouler l'excès de liquide afin de prévenir la dilution du produit de rinçage (p. ex., égouttage d'au moins 1 minute) en prenant soin d'éviter la contamination croisée.
- Glisser la carcasse de dindon dans un sac d'échantillonnage stérile, côté cloaque vers le haut.
- Pendant que l'assistant soutient la carcasse, manipuler la peau lâche du cou depuis l'extérieur du sac et en recouvrir les os du cou de manière à prévenir la perforation du sac.
- L'assistant ouvre le sac d'échantillonnage sans en toucher l'intérieur stérile.
- Préparer l'échantillon
- L'assistant tient le sac ouvert tout en soutenant la carcasse de l'extérieur.
- Ouvrir le récipient contenant le DPB et verser le DPB sur la carcasse qui est dans le sac.
- Prendre le sac des mains de l'assistant, en chasser l'excédent d'air et le fermer en tordant son extrémité, puis en rabattant la partie torsadée.
- Tout en tenant fermement le sac fermé, rincer la carcasse à l'intérieur et à l'extérieur en effectuant un mouvement de balancier pendant environ 1 minute.
Ainsi, on s'assure que l'intérieur et l'extérieur de la carcasse sont rincés.
- Remettre le sac à l'assistant.
- À l'aide d'une main gantée, retirer la carcasse en veillant à ne pas toucher l'intérieur du sac et en laissant l'excédent de liquide s'égoutter dans le sac; replacer la carcasse dans le réservoir de refroidissement ou à l'endroit où elle a été prélevée.
- Expulser l'excédent d'air du sac, en prenant soin de ne pas laisser s'écouler le liquide de rinçage.
Bien refermer le sac afin d'éviter que le liquide de rinçage ne s'écoule ou ne devienne contaminé. Autrement, transférer au moins 30 ml de liquide de rinçage dans un bocal à échantillon stérile.
- Placer le récipient à l'échantillon dans le deuxième sac refermable.
2.4 Méthode de l'éponge pour les carcasses de dindon et d'oie
Matériel d'échantillonnage
- gants stériles;
- éponge stérile de prélèvement d'échantillon dans un sac stérile à fermeture à fil métallique à torsader ou l'équivalent;
- 25 ml de diluant au phosphate de Butterfield (DPB) stérile et prérefroidi;
- sac de plastique stérile autoscellable ou de type Stomacher;
- gabarit stérile de 5 cm sur 10 cm.
Prélèvement des échantillons
- Appliquer les techniques aseptiques décrites dans le document « Procédures d'échantillonnage ».
- Sélectionner l'échantillon, au moment choisi de façon aléatoire.
- Déterminer l'étape du procédé à laquelle les carcasses seront prélevées pour l'échantillonnage : les carcasses sont à sélectionner dans la zone après refroidissement, une fois que toutes les interventions ont eu lieu et après un temps d'égouttage suffisant.
- Sélectionner une carcasse, puis compter 5 carcasses en amont ou en aval et sélectionner la carcasse suivante pour l'échantillonnage (sélection aléatoire, sans biais).
- Si la sixième carcasse n'est pas celle d'un oiseau entier dont la peau est intacte, compter 5 autres carcasses en amont ou en aval pour la sélection de l'échantillon.
- Répéter l'opération jusqu'à ce qu'une carcasse entière soit disponible.
- Dans les établissements où l'emplacement final de la chaîne d'égouttage rend dangereux le retrait d'une carcasse d'une chaîne en mouvement, prélever l'échantillon à la sortie du refroidisseur, directement depuis le convoyeur à courroie.
- Si l'emplacement de l'intervention antimicrobienne finale est temporairement changé en raison d'un événement imprévu (p. ex., défaillance d'équipement), sélectionner une carcasse après l'étape d'intervention finale alternative.
- Prendre la carcasse choisie au hasard; laisser s'écouler l'excès de liquide afin de prévenir la dilution du produit de rinçage (p. ex., égouttage d'au moins 1 minute) en prenant soin d'éviter la contamination croisée.
Ne pas toucher les zones du dos ou des hauts de cuisse.
- Préparer les échantillons en appliquant des techniques aseptiques :
- placer la carcasse sur un support ou la poitrine contre du papier absorbant;
- ne pas laisser les zones d'échantillonnage entrer en contact avec les surfaces;
- ouvrir le sac contenant l'éponge et la bouteille de DPB, en veillant à ne pas contaminer les surfaces intérieures;
- verser soigneusement environ la moitié du contenu de la bouteille de DPB stérile (10 ml) dans le sac contenant l'éponge et reboucher la bouteille;
- fermer le sac et manipuler l'éponge; presser l'éponge et la pousser jusqu'en haut du sac;
- ouvrir les sacs contenant l'éponge et le gabarit; les poser sur une surface désinfectée;
- mettre des gants stériles;
- retirer l'éponge et le gabarit des sacs de manière aseptique;
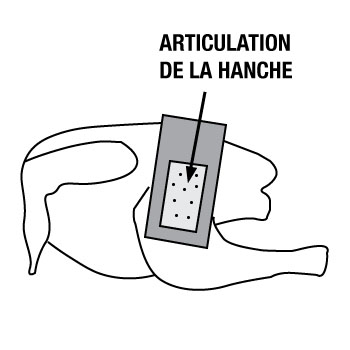
- positionner et maintenir le gabarit juste au-dessus de la queue, sur la colonne vertébrale (image A), en évitant tout contact avec la zone d'échantillonnage;
- passer l'éponge sur toute la surface de l'échantillon (10 passages verticaux et 10 passages horizontaux);
il pourrait être nécessaire de « courber » le gabarit pendant l'épongeage, car la surface de la carcasse n'est pas plane;
- repositionner et maintenir le gabarit sur le haut de cuisse (latéralement p/r à la hanche – image B), en évitant tout contact avec la zone d'échantillonnage;
- retourner l'éponge et passer le côté inutilisé sur toute la zone d'échantillonnage (10 passages verticaux et 10 passages horizontaux);
- placer l'éponge dans le sac d'échantillonnage et fermer le sac; ne pas toucher l'extérieur du sac avec la surface de l'éponge;
- verser le restant du DPB (environ 15 ml) dans le sac contenant l'échantillon afin que le volume total soit d'environ 25 ml;
- appuyer sur la fermeture à fil métallique du sac de l'éponge, expulser l'excès d'air, puis rabattre le bord supérieur du sac 3 ou 4 fois; refermer le tout en repliant la fermeture à fil métallique contre le sac;
- placer le sac contenant l'échantillon dans le deuxième sac refermable, en chassant l'excès d'air;
- placer les éponges de carcasses ensachées sous réfrigération dans les 5 minutes suivant le prélèvement.

3. Préparation de l'expédition
Matériel d'expédition
- sceau d'inviolabilité pour l'échantillon;
- tampon absorbant;
- séparateur(s) en carton;
- paquet(s) de gel réfrigérant congelé(s) (à placer au congélateur 24 heures avant l'expédition);
- contenant d'expédition, avec de la bourre en mousse le cas échéant.
Procédure d'emballage
- assurer l'intégrité et l'identification des échantillons;
- placer les éléments dans le contenant d'expédition dans l'ordre suivant :
- le tampon absorbant;
- le paquet de gel réfrigérant congelé;
- le séparateur de carton;
- le bocal d'échantillonnage ou le sac contenant l'échantillon, glissé dans le deuxième sac à fermeture à glissière, placé en position verticale; ne pas emballer le récipient d'échantillonnage ou l'entourer de ruban adhésif, car le laboratoire pourrait alors refuser l'échantillon;
- un deuxième séparateur en carton suivi d'un deuxième paquet de gel congelé s'il existe un risque accru que la température de l'échantillon soit compromise (p. ex., chaleur estivale, longue durée de transport);
- le cas échéant, la bourre en mousse directement sur le dessus du bocal d'échantillonnage, en appuyant légèrement pour serrer le contenu.
Ne pas trop remplir le contenant d'expédition;
- placer le couvercle isotherme sur le contenant;
- sceller le contenant d'expédition;
- maintenir le conteneur d'expédition à une température appropriée contrôlée jusqu'au moment de l'expédition;
- expédier l'échantillon de manière à ce que l'analyse en laboratoire soit effectuée dans les 24 heures suivant leur prélèvement.
4. Normes de laboratoire relatives aux tests et aux résultats
Pour être éligible à fournir des tests et des résultats, les laboratoires devraient être agréés par le Conseil canadien des normes (CCN) ou la Canadian Association for Laboratory Accreditation Inc. (CALA) et compter dans leur portée d'accréditation la ou les méthodes d'analyse prescrites par Santé Canada ou par le United States Department of Agriculture – Food Safety and Inspection Service (USDA-FSIS), ou d'autres méthodes approuvées.
Les laboratoires peuvent se reporter aux sites Web du Compendium de méthodes de Santé Canada et du Microbiology Laboratory Guidebook du FSIS pour s'assurer que les versions les plus récentes sont utilisées.
Les laboratoires sont responsables de ce qui suit :
- maintenir les conditions d'accréditation du CCN ou de la CALA en vertu des « Prescriptions générales concernant la compétence des laboratoires d'étalonnage et d'essais » (norme ISO/IEC 17025:2005) et des « Exigences relatives à l'accréditation des laboratoires d'analyse des intrants agricoles, des aliments, de la santé des animaux et de la protection des végétaux » (réf. : CAN-P-1587, avril 2008);
- démontrer leur compétence continue pour les tests demandés au moyen d'essais d'aptitude en microbiologie;
- accepter ou éliminer les échantillons reçus pour les tests en suivant les critères pertinents décrits;
- effectuer les tests conformément aux exigences techniques énoncées dans le présent document d'orientation;
- indiquer dans le rapport de laboratoire la méthode précise de Santé Canada ou du FSIS de l'USDA, ou la méthode équivalente qui a été utilisée;
- tenir des registres des tests effectuées.
5. Méthodes d'analyse
Utiliser et adhérer aux méthodes pour lesquelles des CVP ont été publiés. Dans le cas de méthodes pour lesquelles aucun CVP n'a été publié, développer des CVP propres à votre établissement et les recalculer périodiquement, au fur et à mesure de l'amélioration des procédés.
Les échantillons peuvent être analysés en utilisant l'une des méthodes de dénombrement d'E. coli (biotype I) qui figure dans la 16e édition des méthodes officielles d'analyse de l'Association of Official Analytical Chemists (AOAC) International, ou toute autre méthode validée par un organisme scientifique dans le cadre d'essais concertés menés d'après la procédure de nombre plus probable (NPP) à 3 tubes et en accord avec les limites de confiance supérieure et inférieure de 95 % de l'indice NPP approprié.
Méthodes proposées pour le dénombrement d'E. coli
Si l'on utilise une technique générale d'ensemencement de 1 ml sur gélose pour la quantification d'E. coli dans les échantillons prélevés par épongeage sur les carcasses de dindon ou d'oie, il faut diviser le résultat du dénombrement par 4 afin qu'il corresponde au nombre par cm2 de superficie de carcasse (c.-à-d. 100 ÷ 25 = 4).
Il n'est pas nécessaire de recourir à de tels facteurs de conversion pour le dénombrement d'E. coli/ml dans des échantillons prélevés par rinçage des carcasses de volaille. Pour tenir compte des valeurs « marginales » et inacceptables d'E. coli, on devrait ensemencer un extrait non dilué de l'échantillon, ainsi que des dilutions de 1:10, 1:100, 1:1 000 et 1:10 000, de préférence en double. Il peut être nécessaire d'ensemencer des dilutions supérieures ou inférieures selon le produit spécifique.
Si l'on utilise la technique du filtre quadrillé hydrophobe, la seule différence est que les filtrations doivent être effectuées sur 1 ml de l'extrait de l'échantillon non dilué ainsi que sur des dilutions de 1:10, 1:100, 1:1 000 et 1:10 000.
Il peut être nécessaire d'utiliser d'autres dilutions de l'extrait original si l'on utilise le protocole du NPP à trois tubes. On utilise les trois dilutions les plus élevées s'étant révélées positives pour E. coli afin de calculer le NPP. Dans le cas d'échantillons de dindon ou d'oie prélevés par la technique d'épongeage, les valeurs du NPP doivent être divisées par 4 pour obtenir le nombre par cm2 de superficie de carcasse.
Les laboratoires doivent déclarer le dénombrement exact d'E. coli. Lorsque les valeurs sont inférieures à 1 ufc/cm2, le dénombrement exact doit être indiqué (p. ex. 0,01 ufc/cm2) – zéro (0) ne doit pas être indiqué comme résultat de test.
L'AOAC a approuvé les méthodes suivantes pour le dénombrement d'E. coli de type générique dans les aliments :
- méthode NPP à 3 tubes – AOAC 17.2.01 - 17.2.02;
- méthode NPP à 3 tubes modifiée – AOAC 17.3.07 – – Substrate Supporting Disc Method (ColiComplete®);
- méthode NPP à 3 tubes modifiée – AOAC 17.4.01 – Fluorogenic Assay for Glucuronidase; un bouillon tryptosé au lauryl-sulfate auquel on a ajouté du méthyl-4-umbelliféryl-ß-D-glucuronide (MUG) est utilisé pour la méthode NPP à 3 tubes;
- méthode sur plaque – AOAC 17.3.04 – Dry Rehydratable Film Method (Petrifilm/numération sur plaque d'E. coli).
Remarque : À utiliser au lieu de la méthode sur plaque uniquement – Ne pas utiliser comme milieu de contact direct avec la carcasse : voir la méthode AOAC pour obtenir de plus amples précisions.
- Méthode sur plaque/filtration – AOAC 17.3.09 – Membrane filtrante quadrillée hydrophobe/MUG (ISO-GRID).