Sur cette page
- 1. Objet
- 2. Méthodes d'échantillonnage
- 3. Préparation des expéditions
- 4. Normes de laboratoire relatives aux tests et aux résultats
- 5. Méthodes d'analyse
1. Objet
La présente annexe fournit des renseignements pour aider les entreprises alimentaires à recueillir et à préparer des échantillons dans le cadre du Programme de surveillance de la réduction des agents pathogènes (PSRAP) Salmonella et Campylobacter dans la volaille crue.
À vous de choisir!
Vous pouvez utiliser d'autres procédures d'échantillonnage et de test élaborées par des homologues provinciaux, des associations industrielles, des partenaires internationaux ou des organismes universitaires, pour autant qu'elles permettent d'obtenir le même résultat. Assurez-vous toujours que les directives que vous utilisez sont adaptées à votre entreprise, à votre ou vos produits et aux exigences du marché. Assurez-vous de faire vérifier la proposition par L'Agence canadienne d'inspection des aliments (ACIA) pour l'évaluation de l'équivalence avec les pays étrangers.
Ce qui n'est pas inclus dans le présent document!
Bien qu'il fournisse des détails spécifiques sur l'échantillonnage de Salmonella etde Campylobacter dans la volaille, le présent document ne décrit pas de pratiques exemplaires générales en matière d'échantillonnage. Assurez-vous de consulter également le document des Procédures d'échantillonnage.
2. Méthodes d'échantillonnage
2.1 Éléments essentiels à prendre en considération lors de l'échantillonnage
-
Tenir compte du facteur temps pour ce qui concerne les échantillons
Pour obtenir les résultats les plus exacts, le laboratoire devrait tester les échantillons dans les 24 heures suivant leur prélèvement.
-
Lorsque cela n'est pas possible, comme lors des jours fériés ou des fins de semaine, prélever la carcasse et les morceaux de carcasse, conservez-le(s) sous contrôle au réfrigérateur et expédiez-les au laboratoire uniquement lorsqu'il est garanti que le test peut se faire dans les 24 heures suivant son expédition. Par exemple, la carcasse et les morceaux de carcasse prélevés le samedi seront conservés sous contrôle dans la chambre froide, puis l'échantillonnage se fera le lundi et l'échantillon pourra être expédié le même jour.
Pour la volaille hachée finement, lorsque cela n'est pas possible, comme lors des jours fériés ou des fins de semaine, prélever l'échantillon, conservez-le sous contrôle réfrigéré et expédiez‑le au laboratoire uniquement lorsqu'il est garanti que le test sera fait dans les 24 heures suivant son expédition. Par exemple, la volaille finement hachée prélevée un samedi sera conservée sous contrôle dans une chambre froide et expédiée le lundi.
-
N'oubliez pas l'admissibilité des échantillons : la température
Le laboratoire ne testera pas les échantillons congelés (température inférieure à 0°C ou tièdes (température supérieure à 10°C pour le liquide de rinçage).
Les critères d'admissibilité des échantillons sont différents pour chaque agent pathogène, ce qui signifie qu'un échantillon qui n'est pas admissible au test de Campylobacter peut néanmoins être admissible pour Salmonella et être testé pour Salmonella.
Si les échantillons ont besoin d'être envoyés ailleurs, s'assurer que les échantillons sont conservés à des températures de réfrigération jusqu'au moment du transport et expédiés à ces températures au laboratoire effectuant le test. Éviter de placer les boîtes d'expédition près d'une source de chauffage ou dans des zones exposées à une chaleur excessive. Ne pas congeler.
- Soyez prêt pour l'échantillonnage : vérifier que tout le matériel est adapté
- Préparer et étiqueter, au besoin, votre matériel d'échantillonnage avant le prélèvement.
- Envisager de les réunir dans un sac qui contiendra également le matériel nécessaire à la désinfection de la station d'échantillonnage.
-
Vérifier votre milieu d'échantillonnage : jeter toutes les solutions d'eau peptonée tamponnée (EPT) qui sont troubles, turbides ou qui contiennent des particules.
Réfrigérer les solutions 24 heures avant de les utiliser.
-
S'assurer que les supports sont stériles et secs.
Les gabarits peuvent être réutilisables ou non. Ils peuvent être en métal, en papier d'aluminium, en papier brun, en plastique souple, etc.
- Disposez de moyens pour préserver l'intégrité de votre échantillon, comme un sceau inviolable, dès que le prélèvement est terminé.
2.2 Méthode de rinçage pour une carcasse de poulet
Matériel d'échantillonnage
- Grand sac en plastique stérile de 15" × 20" (33 × 44 cm)
- Paire de gants stériles
- Bouteille de 400 ml d'eau peptonée tamponnée (EPT) pré-réfrigérée
- Bocal à échantillon stérile de 120 ml avec couvercle, étiqueté
- Sac refermable de 1 litre avec fermeture à glissière type ziploc (contenant secondaire)
Échantillonnage ‒ rinçage des carcasses de poulet
- Utiliser les techniques aseptiques décrites dans le document Procédures d'échantillonnage
- Sélectionner une carcasse à un moment choisi de manière aléatoire
- Déterminer l'étape du procédé où la carcasse sera sélectionnée pour l'échantillonnage : l'échantillonnage de carcasse est à faire dans la zone post-réfrigération après la fin de toutes les interventions et après un temps d'égouttage suffisant
- sélectionner une carcasse, puis compter 5 carcasses en amont ou en aval et sélectionner la carcasse suivante pour effectuer l'échantillonnage (aléatoire et non biaisée)
- si la sixième carcasse n'est pas une carcasse entière avec sa peau intacte, compter 5 autres carcasses en amont ou en aval pour sélectionner la carcasse
- répéter l'opération jusqu'à tomber sur une carcasse entière
- dans les établissements où l'emplacement final de la chaîne d'égouttage rend dangereux le retrait d'une carcasse d'une chaîne en mouvement, prélever l'échantillon à la sortie du refroidisseur, directement depuis le convoyeur à courroie, ce qui garantira un temps d'égouttage suffisant.
- si l'intervention antimicrobienne finale est temporairement reportée en raison d'un événement imprévu tel une défaillance de l'équipement, sélectionner une carcasse après l'intervention finale de remplacement
- prendre la carcasse sélectionnée de manière aléatoire
-
ouvrir le sac à échantillon sans toucher l'intérieur, qui est stérile.
Ne laissez rien d'autre que la carcasse prélevée toucher l'intérieur du sac à échantillon
- mettre des gants stériles
- saisir le fond extérieur du sac et poussez-le vers le haut pour former un « gant »
- saisir la carcasse par la cuisse; laissez s'écouler l'excès de liquide pour éviter la dilution du produit de rinçage (en laissant par exemple s'égoutter pendant au moins 1 minute) en veillant à éviter toute contamination croisée
- utiliser l'autre main pour tirer le sac, depuis la surface extérieure, sur la carcasse
-
- Préparer l'échantillon
- placer le sac avec la carcasse sur la surface plane et désinfectée
- ouvrir la bouteille d'EPT et verser l'EPT sur la carcasse dans le sac
- manipuler à travers le sac la peau lâche du cou pour qu'elle recouvre les os du cou
- expulser l'excédent d'air du sac, fermez-le en tordant son extrémité et en rabattant la partie torsadée
-
tout en tenant fermement le sac fermé, rincer la carcasse à l'intérieur et à l'extérieur en effectuant un mouvement de balancier pendant environ 1 minute
Cela permet de garantir que l'intérieur et l'extérieur de la carcasse sont rincés
- placer le sac contenant le poulet sur la surface plane désinfectée, le haut du sac tourné vers le haut
- retirer le bouchon vissé du contenant à échantillon stérile, et mettre le bouchon dans le petit sac stérile refermable
- ouvrir le grand sac contenant le poulet et versez 100 ml de liquide EPT dans le contenant à échantillon stérile
- prendre le bouchon vissé du petit sac refermable, et fermer le contenant à échantillon
- s'assurer que le couvercle est correctement vissé, et ne le serrez pas trop.
- placer le contenant à échantillon dans le second sac à fermeture à glissière, en enlevant l'excédent d'air
- jeter le liquide résiduel
- remettre le poulet dans la cuve de refroidissement ou à l'endroit où la carcasse a été prise
Conseil
L'échantillonnage peut également être effectué par 2 personnes portant des gants stériles :
- 1 personne qui tient le sac et le garde ouvert
- 1 personne pour saisir la carcasse et verser l'EPT
2.3 Méthode par épongeage pour une carcasse de dindon
Matériel d'échantillonnage
- 3 paires de gants stériles
- 1 tube de 10 ml d'EPT pré-réfrigérée marqué « S » (Salmonella)
- 1 tube de 25 ml d'EPT pré-réfrigérée marqué « C » (Campylobacter)
- 2 - éponges stériles (écouvillons) pour échantillon dans des sacs à fermeture à glissière marqués; 1 écouvillon étiqueté « C », un écouvillon étiqueté « S ».
- 2 - gabarits stériles 5 cm × 10 cm dans un sac (1 pour Salmonella, 1 pour Campylobacter)
- 2 - sacs à fermeture à glissière refermables de 1 litre (contenant secondaire)
Échantillonnage
- Utiliser les techniques aseptiques décrites dans le document des Procédures d'échantillonnage
- Sélectionner une carcasse à un moment choisi de manière aléatoire
- déterminer l'étape du procédé où la carcasse sera sélectionnée pour l'échantillonnage : l'échantillonnage de carcasse est à faire dans la zone post-réfrigération après la fin de toutes les interventions et après un temps d'égouttage suffisant
- sélectionner une carcasse, puis compter 5 carcasses en amont ou en aval et sélectionner la carcasse suivante pour réaliser l'échantillonnage afin d'éviter tout biais éventuel lors de la sélection
- si la sixième carcasse n'est pas une carcasse entière avec sa peau intacte, compter 5 carcasses supplémentaires en amont ou en aval pour sélectionner la carcasse
- répéter l'opération jusqu'à tomber sur une carcasse entière
- dans les établissements où l'emplacement final de la chaîne d'égouttage rend dangereux le retrait d'une carcasse d'une chaîne en mouvement, prendre l'échantillon à la sortie du refroidisseur, directement sur le convoyeur à courroie
- si l'intervention antimicrobienne finale est temporairement reportée en raison d'un événement imprévu tel qu'une défaillance de l'équipement, sélectionner une carcasse après l'intervention finale de remplacement
-
prendre la carcasse sélectionnée de manière aléatoire; laisser s'écouler l'excès de liquide pour éviter la dilution du produit de rinçage (par exemple en la laissant s'égoutter pendant au moins 1 minute) et assurez-vous d'éviter toute contamination croisée.
Ne touchez pas les zones du dos ou des hauts de cuisses.
- Préparer les échantillons en utilisant des techniques aseptiques et en changeant de gants stériles si nécessaire :
- prélever en premier un échantillon pour Salmonella (matériel d'échantillonnage marqué « S »), sur le côté gauche de la carcasse
- placer la carcasse sur un support ou la poitrine vers le bas sur un essuie-tout
- l'échantillon ne doit pas toucher à aucune surface
- ouvrir le sac à éponge
- verser le contenu de la petite bouteille d'EPT marquée « S » dans le sac à éponge marqué « S »
- fermer le sac et pétrir l'éponge; presser l'éponge et poussez-la jusqu'en au haut du sac
- ouvrir le sac à éponge et le sac à gabarit et placer les sacs sur une surface désinfectée
- récupérer l'éponge et le gabarit de manière aseptique
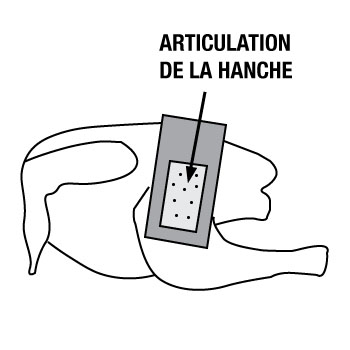
- positionner et tenir le gabarit juste au-dessus de la queue, à gauche de la colonne vertébrale (image A), en évitant tout contact avec la zone de prélèvement
- passer l'éponge sur toute la surface d'échantillonnage (10 fois à la verticale et 10 fois à l'horizontale)
- repositionner et tenir le gabarit au-dessus du haut de cuisse gauche (latéralement à la hanche - image B), en évitant tout contact avec la zone de prélèvement
- retourner l'éponge et passer le côté inutilisé sur toute la zone d'échantillonnage (10 mouvements verticaux et 10 mouvements horizontaux)
- glisser l'éponge dans le sac à échantillon (marqué d'un « S ») et fermer le sac
- jeter le gabarit
- mettre une nouvelle paire de gants stériles pour répéter la même procédure sur le côté droit de la carcasse pour Campylobacter (matériel d'échantillonnage marqué « C »)
- placer les sacs à échantillon dans le sac secondaire à fermeture à glissière, en enlevant l'excédent d'air
- placer le sac d'éponges utilisées pour les carcasses au réfrigérateur dans les 5 minutes suivant la collecte

2.4 Méthode de rinçage des parties pour une carcasse de poulet
Matériel d'échantillonnage
- Sac en plastique stérile de 15" X 20"
- Gants stériles
- Bouteille stérile à large ouverture contenant 400 ml d'eau peptonée tamponnée (EPT) stérile et pré-réfrigérée
- Contenant à échantillon stérile de 120 ml avec couvercle
- Sac refermable de 1 litre avec fermeture à glissière (contenant secondaire)
Échantillonnage - morceaux de poulet
- Utiliser les techniques aseptiques décrites dans le document Procédures d'échantillonnage
- Sélectionner un échantillon à un moment choisi de manière aléatoire
- identifier l'étape du procédé où les morceaux de poulet cru seront sélectionnés pour l'échantillonnage;
-
les morceaux de poulet finis sont à échantillonner avant la congélation, sauf si une intervention visant à réduire la présence de Salmonella ou de Campylobacter est réalisée au moment de la congélation ou après
Par exemple, le produit sera échantillonné dans son emballage final prêt à être utilisé par le consommateur au moment de la dernière intervention appliquée lors de l'emballage.
-
choisir seulement 1 sous-type spécifique de morceau de poulet par échantillonnage, en alternant les sous-types pour chaque échantillonnage.
Par exemple, si vous sélectionnez un filet de poitrine de poulet pour 1 échantillonnage, n'échantillonnez pas d'autres morceaux de poitrine ou d'autres parties telles que les cuisses
- faire un échantillonnage aléatoire des morceaux de poulet sélectionnés, en vous assurant que l'échantillon est représentatif d'une journée complète de production, et :
- représente chaque quart de travail
- représente chaque chaîne de production qui fabrique le produit
- totalise un poids de 1,8 kg (ou 4 lb) ± 10 %
- Préparer l'échantillon
- placer les morceaux de poulet dans le sac à échantillon, en évitant tout transfert de liquide de traitement
- lorsque c'est fait, verser l'EPT dans le sac à échantillon, masser et recueillir immédiatement le liquide de rinçage dans un contenant à échantillon stérile
- placer le contenant renfermant le liquide de rinçage dans un bain de glace immédiatement après la collecte de l'échantillon ou réfrigérer l'échantillon dans les 5 minutes qui suivent
-
conserver le liquide de rinçage dans un réfrigérateur réglé à 4° C ou moins.
Ne congelez pas l'échantillon
- placer le contenant dans le sac à fermeture à glissière secondaire, en retirant l'excédent d'air
2.5 Poulet et dindon crus hachés finement
Matériel d'échantillonnage
- Gants stériles
- Cuillère et spatule stériles (si nécessaire)
- Ciseaux désinfectés pour découper les sacs
- Sacs doublés de 24 oz à fermeture à glissière
- Sac refermable à fermeture à glissière (contenant secondaire)
Échantillonnage
- Utiliser les techniques aseptiques décrites dans le document Procédures d'échantillonnage
- Sélectionner l'échantillon de poulet ou de dindon
-
Identifier l'étape du procédé où le produit sera sélectionné pour l'échantillonnage; la volaille crue, hachée ou hachée finement, est à échantillonner avant la congélation, à moins qu'une intervention visant à réduire la présence de Salmonella ou de Campylobacter soit appliquée au moment de la congélation ou après.
Par exemple, le produit dans son emballage final prêt à être utilisé par le consommateur sera échantillonné au moment del'application de l'intervention finale lors de l'emballage. Dans la mesure du possible, effectuer l'échantillonnage du produit fini dans son emballage final, sinon le faire au moment le plus proche possible de son emballage.
- Choisir le sous-type de produit à échantillonner et étiqueter le matériel d'échantillonnage en conséquence.
-
Effectuer un échantillonnage aléatoire du sous-type de produit choisi parmi les produits admissibles disponibles.
Par exemple, pour « autres produits hachés finement », faire un échantillonnage sur des saucisses crues fraîches et des galettes crues fraîches.
- Prélever un échantillon d'environ 900 grammes ± 10 % du produit choisi
- Pour les produits prélevés dans leur emballage final, glisser l'échantillon emballé dans un sac non stérile
-
Pour les échantillons de produit qui ne sont pas prélevés dans leur emballage final (par exemple, dans un combo/une boîte), prélever l'échantillon de manière aseptique et placez-le dans un sac à échantillon stérile.
Fermer soigneusement le sac de manière hermétique pour éviter toute fuite : expulser l'air, replier fermement le haut du sac 4 fois et fixer fermement les languettes latérales sans les attacher ensemble.
- Placer l'échantillon dans le sac à fermeture à glissière secondaire, en retirant l'excédent d'air.
-
3. Préparation des expéditions
Matériel d'expédition
- Sceau d'échantillon pour l'inviolabilité
- Tampon absorbant
- Séparateur(s) en carton
- Emballage(s) de gel réfrigérant congelé (à placer au congélateur 24 heures avant l'expédition)
- Contenant d'expédition, avec de la bourre en mousse le cas échéant
Procédure d'emballage
- maintenir la sécurité et l'identification des échantillons
- placer dans la boîte d'expédition les éléments suivants dans l'ordre indiqué :
- le tampon absorbant
- le bloc de gel réfrigérant congelé
- le séparateur en carton (cela empêchera l'échantillon de geler)
-
le contenant à échantillon ou le sac à échantillon, déjà à l'intérieur du sac secondaire à fermeture à glissière, placé en position verticale.
Ne posez pas de ruban adhésif sur le contenant à échantillon et ne l'emballez pas, car les laboratoires peuvent refuser l'échantillon.
- un deuxième séparateur en carton suivi d'un deuxième bloc de gel réfrigérant congelé s'il existe un risque supplémentaire que la température de l'échantillon soit compromise (par exemple, chaleur estivale, longue durée de transport)
-
la bourre en mousse, si disponible, directement sur le dessus du contenant à échantillon, en pressant légèrement pour que le contenant ne se déplace pas.
Ne remplissez pas trop la boîte d'expédition
- fermer la boîte avec le couvercle isotherme
- sceller la boîte d'expédition
- maintenir une température appropriée jusqu'au ramassage de la boîte d'expédition
- expédier l'échantillon afin que le test en laboratoire soit effectuée dans les 24 heures suivant son expédition
4. Normes de laboratoire relatives aux tests et aux résultats
Pour être éligible à fournir des tests et des résultats, les laboratoires devraient être accrédités par le Conseil canadien des normes (CCN) ou la Canadian Association for Laboratory Accreditation Inc. (CALA) et disposer, dans leur champ d'application des méthodes approuvées, une ou plusieurs méthodes d'analyse prescrites par Santé Canada et/ou le United States Department of Agriculture - Food Safety and Inspection Service (USDA-FSIS) ou une autre méthode approuvée.
Les laboratoires peuvent se référer aux sites Web du Compendium des méthodes d'analyse de Santé Canada et du Microbiology Laboratory Guidebook - FSIS pour s'assurer que les versions les plus récentes sont utilisées.
Les laboratoires sont responsables de :
- maintenir l'accréditation des laboratoires auprès du CCN ou de la CALA en vertu des normes d'« Exigences générales concernant la compétence des laboratoires d'étalonnages et d'essais » ISO/IEC 17025:2005 et d'« Exigences relatives à l'accréditation des laboratoires d'analyse des intrants agricoles, des aliments, de la santé des animaux et de la protection des végétaux » (réf. CAN-P-1587 avril 2008)
- démontrer une compétence continue pour les tests demandées par le biais d'un plan de vérification des compétences en microbiologie
- accepter et/ou éliminer les échantillons à tester selon les critères applicables décrits
- effectuer des tests conformément aux exigences techniques du présent document d'orientation
- envoyer simultanément et directement les résultats de chaque test à l'inspecteur vétérinaire de l'Agence canadienne d'inspection des aliments (ACIA) de l'établissement et au titulaire de la licence.
- indiquer sur le rapport de laboratoire la méthode spécifique de Santé Canada, de l'USDA-FSIS ou la méthode équivalente approuvée utilisée
- mettre à la disposition de l'ACIA les informations sur l'état des échantillons reçus
- maintenir des registres des tests effectués
5. Méthodes d'analyse
Ces méthodes serviront de référence dans le champ d'application des laboratoires accrédités, notamment :
MLG 4C.07 - FSIS Procedure for the Use of a Polymerase Chain Reaction (PCR) Assay for Screening Salmonella in Meat, Poultry, Egg, and Siluriformes (Fish) Products and Carcass and Environmental Sponges
MLG 4.10 - Isolation and Identification of Salmonella from Meat, Poultry, Pasteurized Egg, and Siluriformes (Fish) Products and Carcass and Environmental Sponges
MFLP-29 - The Qualicon Bax® System Method for the Detection of Salmonella in a Variety of Food and Environmental Samples
MFHPB-20 - Isolation and Identification of Salmonella from Foods
MLG 41.04 - Isolation and Identification of Campylobacter jejuni/coli/lari from Poultry Rinse, Sponge and Raw Product Samples